ГДЗ Химия 9 класc Габриелян О.С. , Остроумов И.Г., Сладков С.А., 2018, §36 УГЛЕВОДОРОДЫ
Во всех упражнениях красным цветом приводится решение, а фиолетовым ― объяснение. |
Упражнение 1 Что является предметом изучения органической химии?
Раздел химии, изучающий строение, свойства, превращения, способы получения и области применения органических веществ, называется органической химией.
Упражнение 2 Что такое химическое строение? Порядок соединения атомов в молекуле вещества.
Как оно отражается на письме? Химическое строение на письме отражает структурная формула.
Упражнение 3 Какие органические вещества называются углеводородами?
Углеводороды – вещества состоящие из атомов углерода и водорода.
На какие группы они подразделяются?
Они делятся на:
― предельные или насыщенные, так как в их молекулах все валентности атомов углерода до предела насыщены атомами водорода (наличие в молекуле одинарной углерод-углеродной связи С―С);
― непредельные или ненасыщенные, так как в них валентности атомов углерода не насыщены до предела атомами водорода (наличие в молекуле двойной углерод-углеродной связи С=С или тройной углерод-углеродной связи С≡С).
Упражнение 4 Дайте сравнительную характеристику углеводородов: метана, этана и пропана. Найдите черты сходства и различия в их строении.
Черты сходства: одинаковый качественный состав веществ (молекулы веществ состоят из атомов двух химических элементов - углерода и водорода), относятся к насыщенным углеводородам.
Черты различия: количественный состав веществ (молекула метана CH4 состоит из одного атома углерода и четырех атомов водорода, молекула этана C2H6 ― из двух атомов углерода и шести атомов водорода, а молекула пропана C3H8 ― из трех атомов углерода и восьми атомов водорода).
Упражнение 5 Дайте сравнительную характеристику углеводородов: этана, этилена и ацетилена. Найдите черты сходства и различия в их строении и свойствах.
Черты сходства: одинаковый качественный состав веществ (молекулы веществ состоят из атомов двух химических элементов - углерода и водорода), относятся к углеводородам.
Черты различия: количественный состав веществ (молекула этана C2H6 состоит из двух атомов углерода и шести атомов водорода, молекула этилена C2H4 ― из двух атомов углерода и четырех атомов водорода, а молекула ацетилена C2H2 ― из двух атомов углерода и двух атомов водорода), относятся к разным группам углеводородов (этан C2H6 ― насыщенный углеводород, этилен C2H4 и ацетилен C2H2 ― ненасыщенные углеводороды), наличие в молекуле особенностей углерод-углеродной связи (в этана одинарная С―С, в этилена двойная С=С, а в ацетилена тройная С≡С).
ПРИМЕНИТЕ СВОИ ЗНАНИЯ
Упражнение 1 Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
C → Be2C → CH4 → CO2 → CaCO3.
C + 2Be → Be2C
Be2C + 4HCl → 2BeCl2 + CH4↑
CH4 + 2O2 → CO2 + 2H2O
CO2 + Ca(OH)2 → CaCO3↓ + H2O
Упражнение 2 Рассчитайте степени окисления атомов углерода в метане, этане и пропане.
C−4H4+1, C2−3H6+1, C3−2,67H8+1
Почему степень окисления атомов углерода в пропане оказалась дробной?
Атомы углерода в пропане находятся в разных степенях окисления: H3C−3−C−2H2−C−3H3
(-3+(-2)+(-3)):3=-2,67
Сравните степени окисления и валентность каждого из трёх углеродных атомов в пропане.
Атомы углерода в пропане находятся в разных степенях окисления: H3C−3−C−2H2−C−3H3, а валентность всех атомов углерода – IV.
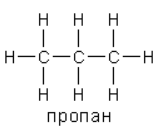
На число валентности указывает количество черточек, которые отходят от символа химического элемента в структурной формуле.
Упражнение 3 При обработке 41,7 г технического карбида кальция избытком соляной кислоты выделилось 13,44 л ацетилена (при н.у.). Рассчитайте массовую долю карбида кальция в техническом образце.
Дано: mтехн.(CaC2)=41,7 г, V(C2H2)=13,44 л
Найти: ω(CaC2)-?
Решение
1-й способ
1. Количество вещества ацетилена объемом 13,44 л рассчитываем по формуле: ʋ=V/VM, где VM=22,4 л/моль при н.у.
ʋ(C2H2)=V(C2H2)/VM=13,4 л : 22,4 л/моль=0,6 моль
2. Составим химическое уравнение:
CaC2 + 2HCl= CaCl2 + C2H2↑
По уравнению реакции ʋ(CaC2):ʋ(C2H2)=1:1, количества вещества одинаковые, поэтому:
ʋ(CaC2)=ʋ(C2H2)=0,6 моль
3. Массу чистого карбида кальция количеством вещества 0,6 моль рассчитываем по формуле: m=ʋ•M, где M=Mr г/моль.
Mr(CaC2)=Ar(Ca)+2•Ar(C)=40+2•12=64, M(CaC2)=64 г/моль
m(CaC2)=ʋ(CaC2)•M(CaC2)=0,6 моль • 64 г/моль=38,4 г
4. Рассчитываем массовую долю чистого карбида кальция в техническом карбиде кальция:
ω(CaC2)=m(CaC2):mтехн.(CaC2)•100%=38,4 кг : 41,7 г • 100%=92,1%
2-й способ
1. Составим химическое уравнение:
х г 13,44 л
CaC2 + 2HCl= CaCl2 + C2H2↑
64 г 22,4 л
Над формулами соединений CaС2 и С2Н2 записываем неизвестную массу чистого карбида кальция (х г) и приведенный в условии задачи объём ацетилена (13,44 л), а под формулами соединений ― массу и объём соответствующего количества вещества согласно коэффициентам в химическом уравнении. Для этого вычисляем молярную массу (M=Mr г/моль) и, соответственно, массу 1 моль CaC2 и объём 1 моль C2H2 (при н.у. 1 моль газов занимает объём 22,4 л).
Mr(CaC2)=Ar(Ca)+2•Ar(C)=40+2•12=64, M(CaC2)=64 г/моль, масса 1 моль=64 г
2. Массу чистого карбида кальция рассчитываем с помощью пропорции:
х г / 64 г =13,44 л / 22,4 л, отсюда по свойству пропорции имеем
х г • 22,4 л = 13,44 л • 64 г, поэтому
х=m(CaC2)=13,44 л • 64 г : 22,4 л=38,4 г
3. Рассчитываем массовую долю чистого карбида кальция в техническом карбиде кальция:
ω(CaC2)=m(CaC2):mтехн.(CaC2)•100%=38,4 кг : 41,7 г • 100%=92,1%
Ответ: 92,1%
Похожие новости
Комментарии
Часто задаваемые вопросы
Для чего создан сайт?
Чтобы помочь ученикам.
У вас нет ГДЗ для моего учебника (
Это не проблема. Напиши нам чего нет и мы добавим.
Как с вами связатся?
Через почту: admin@gdz.cool или обратную связь.
Вам можно предложить учебник для ГДЗ?
Да. Отправь учебник на электронную почту, чтобы мы его решили.
В каком классе вы учитесь?
Социальные сети