ГДЗ Химия 9 класc Габриелян О.С. , Остроумов И.Г., Сладков С.А., 2018, §25 ХАЛЬКОГЕНЫ. КИСЛОРОД
Во всех упражнениях красным цветом приводится решение, а фиолетовым ― объяснение. |
Упражнение 1 Дайте сравнительную характеристику элементов VIA группы на основании их положения в Периодической системе Д.И.Менделеева.
Халькогены располагаются в VIА группе, содержат 6 электронов на внешнем энергетическом уровне, принадлежат к неметаллам (кроме полония — редкий по распространённости, радиоактивный элемент уже принято считать металлом).
В ряду O―Te неметаллические свойства ослабевают, а металлические усиливаются.
Минимальная степень окисления -2, а максимальная +6.
Формула высших оксидов ЭO3, они проявляют кислотные свойства.
Формула высших гидроксидов H2ЭO4, они проявляют кислотные свойства.
Формула летучего водородного соединения H2Э, элементы содержатся в минимальной степени окисления -2.
Упражнение 2 Назовите аллотропные модификации кислорода и сравните их свойства.
Для кислорода характерны две аллотропные модификации: кислород O2 и озон O3. Эти простые вещества различаются числом атомов в молекуле.
Сравнение физических свойств.
Кислород ― бесцветный газ, без вкуса и запаха, малорастворим в воде, плотность при н.у. 1,43 г/л.
Озон ― голубой газ с характерным запахом свежести, ядовит, намного лучше растворяется в воде, чем кислород, плотность в 1,5 раза больше, чем у кислорода, то есть 2,1 г/л.
Сравнение химических свойств.
Кислород взаимодействует со многими веществами при нагревании с выделением тепла и света.
Озон значительно более химически активен, чем кислород. Это связано с тем, что молекула озона распадается на атом и молекулу кислорода (O3=O2+O), а атомарный кислород намного активнее молекулярного. В атмосфере озона некоторые вещества (спирт, фосфор) воспламеняются, каучук становится хрупким, а красители обесцвечиваются.
Упражнение 3 Запишите уравнения реакций получения кислорода в лаборатории.
Наиболее удобным способом получения кислорода в лаборатории является разложение перманганата калия при нагревании.
2KMnO4⟶ K2MnO4 + MnO2 + O2↑
Другим дабораторным способом получения кислорода служит разложение пероксида водорода в присутствии катализатора оксида марганца (IV) для ускорения реакции:
2H2O2 ⟶ 2H2O + O2↑ (кат. MnO2)
Каким образом можно:
а) собрать кислород в пробирку;
Кислород можно собрать методом вытеснения воздуха, держа пробирку вниз дном (кислород тяжелее воздуха), или методом вытеснения воды (кислород плохо растворяется в воде).
б) доказать наличие кислорода в сосуде?
Можно с помощью тлеющей лучины, которая ярко вспыхнет при наличии кислорода, т.к. кислород поддерживает горение.
Упражнение 4 Как кислород получают в промышленности?
Двумя способами:
1-й способ. Кислород добывают фракционной перегонкой (или ректификацией) жидкого воздуха в специальных аппаратах, называемых ректификационными колоннами.
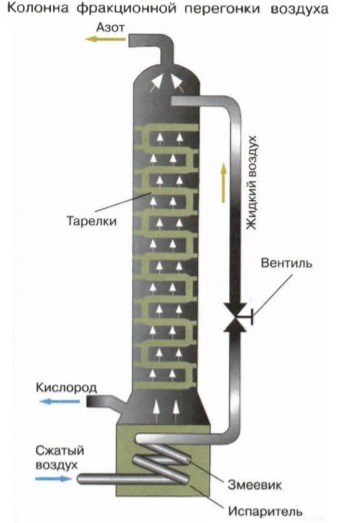
С помощью специальных компрессоров воздух сжимают и охлаждают, при этом все его компоненты переходят в жидкое агрегатное состояние. Жидкий воздух подают в верхнюю часть ректификационной колонны, представляющую собой высокий цилиндр, разделённый множеством поперечных перегородок — тарелок. Стекая по тарелкам, жидкость постепенно нагревается, при этом из неё начинает испаряться самый легкокипящий компонент — азот (tкип.-196°С), который поднимается в верхнюю часть колонны, а стекающая в нижний резервуар жидкость представляет собой жидкий кислород (tкип.-183°С).
2-й способ. Часто в промышленности кислород добывают реакцией разложения воды - электролизом (под действием электрического тока вода разлагается на два простые вещества — кислород и водород):
2H2O = 2H2↑ + O2↑ (электр.ток)
Газообразный кислород хранят в стальных баллонах, окрашенных в синий цвет, а жидкий — в сосудах Дьюара (специальные сосуды с двойными стенками, между которыми вакуум, по строению они напоминают обычный термос).
Назовите области применения кислорода.
В металлургии и химической промышленности, для газовой сварки и резки металлов, в качестве окислителя ракетного топлива космических кораблей, для жизнеобеспечения на подводных лодках, орбитальных станциях и в авиационной технике. В медицине кислород применяют в случаях временного затруднения дыхания, связанного с некоторыми заболеваниями.
ПРИМЕНИТЕ СВОИ ЗНАНИЯ
Упражнение 1. Запишите уравнения реакций, с помощью которых можно осуществить превращения по таким схемам, причем для реакций обмена запишите уравнения в ионном виде, а для окислительно-восстановительных реакций расставьте коэффициенты методом электронного баланса, укажите окислители и восстановители:
а) H2O2 → O2 → SO2 → SO3 → H2SO4 → MgSO4;
2H2O2 = 2H2O + O2 (кат.MnO2)
Схема окислительно-восстановительной реакции (тип ОВР: диспропорционирование (самоокисление-самовосстановление) — реакции, в ходе которых и окисляются, и восстанавливаются атомы одного химического элемента).
H2O2-1 ⟶ H2O-2 + O20
2O-1 -2ē ⟶ O20 |2|2|х1 ― процесс окисления
O-1 +1ē ⟶ O-2 |1| |х2 ― процесс восстановления
Проводим вертикальную черту и пишем за ней число электронов, которые отдали и присоединили атомы кислорода. Находим наименьшее общее кратное для чисел 2 и 1. Это число 2, которое записываем за второй вертикальной чертой посередине, и поделив его поочередно на 2 и 1, записываем результат за третьей чертой в строках, касающихся элементов кислорода. Числа в последнем столбце — 1 и 2 — это дополнительные множители в схемах соответствующих процессов:
2O-1 -2ē ⟶ O20
2O-1 +2ē ⟶ 2O-2
Добавим почленно эти уравнения, получим суммарную схему:
4O-1 ⟶ O20 + 2O-2
Эти коэффициенты переносим в уравнение реакции (обратите внимание: два атома O-1 уже есть в составе H2O2, поэтому около H2O2 ставим коэффициент 2).
2H2O2-1 ⟶ 2H2O-2 + O20
Проверяем, уравнялось ли число атомов элементов, которых не было в схемах окисления и восстановления. Число атомов водорода одинаковое: по 4 атома.
В приведённой реакции кислород является восстановителем и окислителем.
O2 + S = SO2
Схема окислительно-восстановительной реакции.
O20 + S0 ⟶ S+4O2-2
Восстановитель S0 -4ē ⟶ S+4 |4|4|1 ― процесс окисления
Окислитель O20 +4ē ⟶ 2O-2 |4| |1 ― процесс восстановления
Проводим вертикальную черту и пишем за ней число электронов, которые отдали и присоединили атомы серы и кислорода. Находим наименьшее общее кратное для чисел 4 и 4. Это число 4, которое записываем за второй вертикальной чертой посередине, и поделив его поочередно на 4 и 4, записываем результат за третьей чертой в строках, касающихся элементов серы и кислорода. Множители 1 и 1 являются искомыми коэффициентами. Поскольку элементы изменили степень окисления полностью (в правой части схемы эти элементы ни в одном веществе не проявляют такую же степень окисления, как в исходном веществе) и одинаковыми являются индексы этих элементов в формуле исходного вещества и продукта реакции, поэтому ставим коэффициент 1 (который обычно не пишем) перед формулой всех соединений (O2, S, SO2).
2SO2 + O2 ⇄ 2SO3
Схема окислительно-восстановительной реакции.
S+4O2 + O20 ⇄ S+6O3-2
S+4 -2ē ⟶ S+6 |2|4|2 ― процесс окисления
O20 +4ē ⟶ 2O-2 |4| |1 ― процесс восстановления
Проводим вертикальную черту и пишем за ней число электронов, которые отдали и присоединили атомы серы и кислорода. Находим наименьшее общее кратное для чисел 2 и 4. Это число 4, которое записываем за второй вертикальной чертой посередине, и поделив его поочередно на 2 и 4, записываем результат за третьей чертой в строках, касающихся элементов серы и кислорода. Множители 2 и 1 являются искомыми коэффициентами. Поскольку элементы изменили степень окисления полностью (в правой части схемы эти элементы ни в одном веществе не проявляют такую же степень окисления, как в исходном веществе) и одинаковыми являются индексы элемента серы в формуле исходного вещества и продукта реакции, поэтому ставим коэффициент 2 перед формулой двух соединений серы (SO2, SO3), а разными являются индексы элемента кислорода в формуле исходного вещества и продукта реакции, поэтому ставим коэффициент 1 (который обычно не пишем) перед формулой кислорода О2.
В приведённой реакции оксид серы (IV) (за счёт атомов серы в степени окисления +4) — восстановитель, а кислород— окислитель.
SO3 + H2O = H2SO4
H2SO4 + Mg(OH)2 = MgSO4 + 2H2O
Сначала по таблице растворимости определяем растворимые соединения, а затем — какие из них являются сильными электролитами.
H2SO4 и MgSO4— это сильные электролиты, которые в водном растворе содержатся исключительно в виде ионов, а Mg(OH)2 и Н2О — слабые электролиты. Заменяем формулы сильных электролитов формулами ионов:
2H+ + SO42- + Mg(OH)2 ⟶ Mg2+ + SO42- + 2H2O
С обеих частей полученного уравнения изымаем (подчеркнутые) одинаковые ионы в одинаковых количествах SO42-:
2H+ + Mg(OH)2 ⟶ Mg2+ + 2H2O
б) KMnO4 → O2 → Li2O → Li2S → SO2.
2KMnO4 = K2MnO4 + MnO2 + O2↑
Схема окислительно-восстановительной реакции (тип ОВР: внутримолекулярные окислительно-восстановительные реакции ― реакции, окислителем и восстановителем в которых один и тот же реагент).
KMn+7O4-2 ⟶ K2Mn+6O4 + Mn+4O2 + O20
Mn+7 +1e → Mn+6
Mn+7 +3e → Mn+4
---------------------------------
2Mn+7 +4e → Mn+6 + Mn+4 |4|4|х1 ― процесс восстановления
2O-2 -4e → O20 |4| |х1 ― процесс окисления
Проводим вертикальную черту и пишем за ней число электронов, которые присоединили и отдали атомы марганца и кислорода. Находим наименьшее общее кратное для чисел 4 и 4 (количество присоединенных электронов 4 и отданных электронов 4). Это число 4, которое записываем за второй вертикальной чертой посередине, и поделив его поочередно на 4 и 4, записываем результат за третьей чертой в строках, касающихся элементов марганца и кислорода. Числа в последнем столбце ― 1 и 1 ― это дополнительные множители в схемах соответствующих процессов:
2Mn+7 +4e → Mn+6 + Mn+4
2O-2 -4e → O20
Добавим почленно эти уравнения, получим суммарную схему:
2Mn+7 + 2O-2 → Mn+6 + Mn+4 + O20
Эти коэффициенты переносим в уравнение реакции (обратите внимание: коэффициент 2 перед О-2 не относится к составу KMnO4, так как часть атомов кислорода в ионе MnО4-1 не окислилась, а вошла в состав K2MnO4 и MnO2. Вычисляем общее количество атомов кислорода в правой части уравнения: их есть 8 (4+2+2), следовательно, перед формулой перманганата калия должен стоять коэффициент 2, поскольку четыре атома O-2 уже есть в составе K2MnO4):
2KMn+7O4-2 ⟶ K2Mn+6O4 + Mn+4O2 + O20
Проверяем, уравнялось ли число атомов элементов, которых не было в схемах окисления и восстановления. Число атомов калия в обеих частях одинаковое: по 2 атома.
В приведённой реакции перманганат калия является восстановителем и окислителем.
O2 + 4Li = 2Li2O
Схема окислительно-восстановительной реакции.
O20 + Li0 ⟶ 2Li2+1O-2
Восстановитель Li0 -1ē ⟶ Li+1 |1|4|4 ― процесс окисления
Окислитель O20 +4ē ⟶ 2O-2 |4| |1 ― процесс восстановления
Проводим вертикальную черту и пишем за ней число электронов, которые отдали и присоединили атомы лития и кислорода. Находим наименьшее общее кратное для чисел 1 и 4. Это число 4, которое записываем за второй вертикальной чертой посередине, и поделив его поочередно на 1 и 4, записываем результат за третьей чертой в строках, касающихся элементов лития и кислорода. Множители 4 и 1 являются искомыми коэффициентами. Поскольку элементы изменили степень окисления полностью (в правой части схемы эти элементы ни в одном веществе не проявляют такую же степень окисления, как в исходном веществе) и разными являются индексы элементов в формуле исходного вещества и продукта реакции, поэтому коэффициент 4 ставим перед формулой лития, а коэффициэнт 1 (который обычно не пишем) ― перед формулой кислорода:
O2 + 4Li ⟶ Li2O
Подбираем коэффициенты для остальных соединений.
Li2O + H2S = Li2S + H2O (прокадивание оксида в токе сухого сероводорода при температуре 9000-10000С, а не в растворе)
2Li2S + 3O2 ⟶ 2Li2O + 2SO2
Схема окислительно-восстановительной реакции.
Li2S-2 + O20 ⟶ Li2O-2 + S+4O2-2
S-2 -6ē ⟶ S+4 |6|12|2 ― процесс окисления
O20 +4ē ⟶ 2O-2 |4| |3 ― процесс восстановления
Проводим вертикальную черту и пишем за ней число электронов, которые отдали и присоединили атомы серы и кислорода. Находим наименьшее общее кратное для чисел 6 и 4. Это число 12, которое записываем за второй вертикальной чертой посередине, и поделив его поочередно на 6 и 4, записываем результат за третьей чертой в строках, касающихся элементов серы и кислорода. Множители 2 и 3 являются искомыми коэффициентами. Поскольку элемент сера изменил степень окисления полностью (в правой части схемы этот элемент ни в одном веществе не проявляет такую же степень окисления, как в исходном веществе) и одинаковыми являются индексы этого элемента в формуле исходного вещества и продукта реакции, поэтому ставим коэффициент 2 перед формулой двух соединений серы (Li2S, SO2). Поскольку элемент кислород изменил степень окисления не полностью (часть атомов кислорода не восстановилась, а вошла в состав оксида лития), поэтому ставим коэффициент 3 только перед перед формулой кислорода:
2Li2S + 3O2 ⟶ Li2O + 2SO2
Подбираем коэффициенты для остальных соединений.
В приведённой реакции сульфид лития (за счёт атомов серы в степени окисления -2) — восстановитель, а кислород — окислитель.
Упражнение 2 Присутствие кислорода в атмосфере Земли делает её уникальной для существования живых существ планетой Солнечной системы. Однако известно и негативное влияние кислорода. Приведите примеры отрицательных явлений, связанных с наличием кислорода в воздухе. Предложите методы борьбы с этими явлениями.
Процессы гниения и разложения (порча) продуктов питания. Метод борьбы: охлаждение или заморозка, использование вакуумной упаковки.
Коррозия металлов. Метод борьбы: нанесение защитных покрытий на поверхность металлического изделия (окраска лаками, красками, эмалями), добавка легирующих элементов (например, замена металла нержавеющей сталью), изменение состава поверхностного слоя металлического изделия (воронение — частный случай процесса оксидирования), использование ингибиторов (вещества, которые уменьшают скорость коррозии, например, специальная добавка к антифризам), протекторная защита (контакт металлического изделия с более активным металлом (протектором)).
При вдыхании воздуха, содержащего более 60% кислорода, у человека может возникнуть «кислородное отравление» ― гипероксия, от которой чаще всего страдают водолазы или пациенты, использующие кислородные аппараты. Метод борьбы: тщательный контроль технической исправности соответствующих аппаратов, а также строгое соблюдение техники безопасности.
Упражнение 3. Исторически одним из самых первых способов получения кислорода была реакция разложения оксида ртути (II) в соответствии со следующим химическим уравнением: 2НgО = 2Hg + O2↑. Для разложения 13,02 г оксида ртути потребовалось 5,46 кДж теплоты. Рассчитайте тепловой эффект химической реакции.
Рассчитаем количество вещества ртути массой 13,02 г по формуле n=m/M, где М=Mr г/моль.
M(Hg)=Mr(Hg) г/моль=201 г/моль
ʋ(Hg)=m(Hg)/M(Hg)=13,02 г : 201 г/моль=0,06 моль
Составляем пропорцию и решаем её.
По условию задачи для разложения 0,06 моль Hg потребуется 5,46 кДж теплоты, а
по уравнению реакции для 2 моль Hg — х кДж теплоты.
х=5,46 кДж ● 2 кДж : 0,06 моль=182 кДж
2НgО = 2Hg + O2↑ -182 кДж
Похожие новости
Комментарии
Часто задаваемые вопросы
Для чего создан сайт?
Чтобы помочь ученикам.
У вас нет ГДЗ для моего учебника (
Это не проблема. Напиши нам чего нет и мы добавим.
Как с вами связатся?
Через почту: admin@gdz.cool или обратную связь.
Вам можно предложить учебник для ГДЗ?
Да. Отправь учебник на электронную почту, чтобы мы его решили.
В каком классе вы учитесь?
Социальные сети