ГДЗ / ответы Химия 8 класc Кузнецова Н.Е. §49 Окислительно-восстановительные реакции
Во всех упражнениях красным цветом приводится решение, а фиолетовым ― объяснение. |
Окисление ― процесс отдачи электронов атомом, молекулой или ионом, а вещество, которое во время химической реакции отдает электроны, называется восстановителем. Восстановление ― процесс присоединения электронов атомом, молекулой или ионом, а вещество, которое во время химической реакции присоедняет электроны, называется окислителем.
Итак, окислитель в процессе реакции восстанавливается, а восстановитель ― окисляется.
Задание 2 Что показывает степень окисления?
Степень окисления показывает условный заряд атома в химическом соединении, если предположить, что оно состоит из ионов. В окислительно-восстановительных реакциях степень окисления показывает сколько электронов принял или отдал атом элемента.
Как она изменяется при окислении и восстановлении элементов?
При окислении элементов степень окисления повышается, а при восстановлении ― понижается.
Задание 3 Определите, окисляется или восстанавливается сера при переходах:
а) H2S ⟶ SO2 ⟶ SO3;
H2S−2 ⟶ S+4O2 ⟶ S+6O3 – степень окисления серы повышается от -2 через +4 до +6, следовательно, сера окисляется.
б) SO2 ⟶ H2SO3 ⟶ K2SO3.
S+4O2 ⟶ H2S+4O3⟶K2S+4O3 – степень окисления серы не изменяется, следовательно, сера не окисляется и не восстанавливается.
Задание 4 Определите, какие из перечисленных реакций относятся к окислительно-восстановительным:
1) Mg + HCl ⟶ MgCl2 + H2; Окислительно-восстановительная реакция, т. к. сопровождается изменением степени окисления атомов элементов.
Mg0 + H+1Cl ⟶ Mg+2Cl2 + H20
2) MgO + НСl ⟶ MgCl2 + H2O;
Mg+2O-2 + Н+1Сl-1 ⟶ Mg+2Cl2-1 + H2+2O-2 Не является окислительно-восстановительной реакцией, т. к. не сопровождается изменением степени окисления атомов элементов.
3) CaO + CO2 ⟶ CaCO3;
Ca+2O-2 + C+4O2-2 ⟶ Ca+2C+4O3-2 Не является окислительно-восстановительной реакцией, т. к. не сопровождается изменением степени окисления атомов элементов.
4) FeCl3 + KI ⟶ I2 + FeCl2 + KCl. Окислительно-восстановительная реакция, т. к. сопровождается изменением степени окисления атомов элементов.
Составьте схему реакции 4, указав окислитель и восстановитель, окислительный и восстановительный процессы.
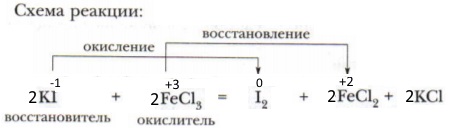
В приведённой реакции иодид калия (за счёт атомов йода в степени окисления -1) — восстановитель, а хлорид железа (III) (за счёт атомов железа а в степени окисления +3) — окислитель.
Задание 5 Выберите схемы превращений, в которых азот является окислителем.
1) N+5 ⟶ N+2; Азот окислитель, поскольку степень окисления азота понижается от +5 до +2
2) N+3 ⟶ N+5;
3) N0 ⟶ N+2;
4) N0 ⟶ N-3; Азот окислитель, поскольку степень окисления азота понижается от 0 до -3
5) N-3 ⟶ N0.
Ответ 1), 4)
Похожие новости
Комментарии
Часто задаваемые вопросы
Для чего создан сайт?
Чтобы помочь ученикам.
У вас нет ГДЗ для моего учебника (
Это не проблема. Напиши нам чего нет и мы добавим.
Как с вами связатся?
Через почту: admin@gdz.cool или обратную связь.
Вам можно предложить учебник для ГДЗ?
Да. Отправь учебник на электронную почту, чтобы мы его решили.
В каком классе вы учитесь?
Социальные сети