ГДЗ (ответы) Химия. Вводный курс. 7 класc Габриелян О.С., Остроумов И.Г., Ахлебинин А.К. 2019, §11 Массовая доля элемента в сложном веществе.
Красным цветом приводится решение, а фиолетовым ― объяснение. |
Что называется массовой долей элемента в сложном веществе?
Массовой долей элемента называется отношение массы этого элемента в сложном веществе к массе всего вещества, выраженное в долях единицы (или процентах).
Как рассчитывается эта величина? Массовая доля элемента рассчитывается по формуле:
 (1)
(1)или
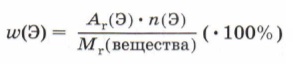 (2)
(2)Для расчета массовой доли элемента в формуле (2) нужно его относительную атомную массу умножить на число атомов данного элемента в формуле и разделить на относительную молекулярную массу вещества.
Задание 2
Рассчитайте массовые доли элементов в веществах:
а) углекислом газе CO2;
Mr(CO2)=Ar(C)+2•Ar(O)=12+2•16=44
ω(C)=Ar(C):Mr(CO2)=12:44=0,27, или,
умножив это значение на 100%, получим 27,27%
ω(O)=2•Ar(C):Mr(CO2)=2•12:44=0,7272, или 72,72%
Массовую долю кислорода можно найти ещё и так:
ω(O)=1-ω(C)=1-0,2727=0,7272
или так:
ω(O)=100%-ω(C)=100%-27,27%=72,72%
б) сульфиде кальция CaS;
Mr(CaS)=Ar(Ca)+Ar(S)=40+32=72
ω(Ca)=Ar(Ca):Mr(CaS)=40:72=0,556, или 55,6%
ω(S)=Ar(S):Mr(CaS)=32•72:44=0,444, или 44,4%
Массовую долю серы можно найти ещё и так:
ω(O)=1-ω(Ca)=1-0,556=0,444
или так:
ω(S)=100%-ω(Ca)=100%-55,6%=44,4%
в) натриевой селитре NaNO3;
Mr(NaNO3)=Ar(Na)+Ar(N)+3•Ar(O)=23+14+3•16=85
ω(Na)=Ar(Na):Mr(NaNO3)•100%=23:85•100%=27%
ω(N)=Ar(N):Mr(NaNO3)•100%=14:85•100%=16,5%
ω(O)=100%-ω(Na)-ω(N)=100%-27%-16,5%=56,5%
г) оксиде алюминия Al2O3.
Mr(Al2O3)=2•Ar(Al)+3•Ar(O)=2•27+3•16=102
ω(Al)=2•Ar(Al):Mr(Al2O3)•100%=2•27:102•100%=53%
ω(O)=100%-ω(Al)=100%-53%=47%
Задание 3
В каком из азотных удобрений массовая доля питательного элемента азота наибольшая:
а) хлориде аммония NH4Cl;
Mr(NH4Cl)=Ar(N)+4•Ar(H)+Ar(Cl)=14+4•1+35,5=53,5
ω(N)=Ar(N):Mr(NH4Cl)•100%=14:53,5•100%=26,2%
б) сульфате аммония (NH4)2SO4;
Mr((NH4)2SO4)=2•Ar(N)+8•Ar(H)+Ar(S)+4•Ar(O)=2•14+8•1+32+4•16=132
ω(N)=2•Ar(N):Mr((NH4)2SO4)•100%=2•14:132•100%=21,2%
в) мочевине (NH2)2CO?
Mr((NH2)2CO)=2•Ar(N)+4•Ar(H)+Ar(C)+Ar(O)=2•14+4•1+12+16=60
ω(N)=2•Ar(N):Mr((NH2)2CO)•100%=2•14:60•100%=46,7%
Ответ: наибольшая массовая доля азота в мочевине (NH2)2CO (46,7%).
Задание 4
В минерале пирите на 7 г железа приходится 8 г серы. Вычислите массовые доли каждого элемента в этом веществе и определите его формулу.
Дано: m(Fe)=7 г, m(S)=8 г
Найти: ω(Fe)-?, ω(S)-? формулу FexSy-?
Решение
1. Рассчитываем массу вещества:
m(вещества)=m(Fe)+m(S)=7 г + 8 г=15 г
2. Вычисляем массовые доли железа и серы в пирите:
ω(Fe)=(m(Fe)/m(вещества))•100%=(7 г:15 г)•100%=46,67%
ω(S)=(m(S)/m(вещества))•100%=(8 г:15 г)•100%=53,33%
3. Определить формулу пирита можно несколькими способами:
1-й способ
Отношение количества атомов находят как деление числовых значений массовых долей химических элементов, входящих в состав данного вещества, на их относительные атомные массы:
x:у=ω(Fe)/Ar(Fe) : ω(S)/Ar(S)=0,4667/56 : 0,5333/32=0,008:0,016
Если соотношение между атомами выражено не целыми, а дробными числами, то считаем, что меньшее число (0,008) равно единице и большее число делим на него:
x:у=0,008/0,008 : 0,016/0,008=1:2, следовательно, химическая формула соединения FeS2
2-й способ
В 100 г пирита масса атомов железа составляет 46,67 г, а атомов серы ― 53,33 г. Рассчитываем соотношение индексов в формуле (соотношение количества вещества элементов):
х:у=n(Fe):n(S)=m(Fe)/M(Fe) : m(S)/M(S)=46,67/56 : 53,33/32=0,833:1,666
Если соотношение между атомами выражено не целыми, а дробными числами, то считаем, что меньшее число (0,833) равно единице и большее число делим на него:
х:у=0,833/0,833 : 1,666/0,833=1:2, следовательно, формула имеет вид FeS2
3-й способ
С формулы вычисления массовой доли элемента ω(Fe)=xAr(Fe):M(FexSу) выражаем молярную массу вещества:
M(FexSу)=xAr(Fe)/ω(Fe)=56х/0,4667=120х
По определению M(FexSу)=xAr(Fe)+yAr(S)=56x+32y
Приравняем левую и правую части выражений, получим уравнение:
120х=56х+32у
120х-56х=32у
64х=32у
x/y=32/62
x/y=1/2
можна записать так:
х:у=1:2, что соответствует формуле FeS2
Ответ: ω(Fe)=46,67%, ω(S)=53,33%; формула пирита FeS2.
Задание 5
Массовая доля азота в одном из его оксидов равна 30,43%, а массовая доля кислорода – 69,57%. Определите формулу оксида.
Дано: ω(N)=30,43%, или 0,3043, ω(O)=69,57%, или 0,6957
Найти формулу NxOy - ?
Решение
1-й способ
Отношение количества атомов находят как деление числовых значений массовых долей химических элементов, входящих в состав данного вещества, на их относительные атомные массы:
x:у=ω(N)/Ar(N) : ω(O)/Ar(O)=0,3043/14 : 0,6957/16=0,021:0,043
Если соотношение между атомами выражено не целыми, а дробными числами, то считаем, что меньшее число (0,021) равно единице и большее число делим на него:
x:у=0,021/0,021 : 0,043/0,021=1:2, следовательно, химическая формула соединения NO2
2-й способ
В 100 г оксида масса атомов азота составляет 30,43 г, а атомов кислорода ― 69,57 г. Рассчитываем соотношение индексов в формуле (соотношение количества вещества элементов):
х:у=n(N):n(O)=m(N)/M(N) : m(O)/M(O)=30,43/14 : 69,57/16=2,174:4,348
Если соотношение между атомами выражено не целыми, а дробными числами, то считаем, что меньшее число (2,174) равно единице и большее число делим на него:
х:у=2,174/2,174 : 4,348/2,174=1:2, следовательно, формула имеет вид NO2
3-й способ
С формулы вычисления массовой доли элемента ω(N)=xAr(N):M(NxOу) выражаем молярную массу вещества:
M(NxOу)=xAr(N)/ω(N)=14х/0,3043=46х
По определению M(NxOу)=xAr(N)+yAr(O)=14x+16y
Приравняем левую и правую части выражений, получим уравнение:
46х=14х+16у
46х-14х=16у
32х=16у
x/y=16/32
x/y=2
можна записать так:
х:у=2:1, что соответствует формуле NO2
Ответ: NO2.
Для тех, кто хочет знать больше. Покажем, почему отношение количества атомов находят как деление числовых значений массовых долей химических элементов, входящих в состав данного вещества, на их относительные атомные массы.
Из формул вычисления массовых долей элементов E1 и Е2 в веществе:
ω1=х•Ar(Е1)/Mr и ω2=y•Ar(Е2)/Mr,
выразим количества атомов:
x=(ω1•Mr)/Ar(Е1) и y=(ω2•Mr)/Ar(Е2)
и вычислим их отношение:
x:y =(ω1•Mr)/Ar(Е1) : (ω2•Mr)/Ar(Е2)=(ω1•Mr)/Ar(Е1) • Ar(Е2)/(ω2•Mr)=(ω1/Ar(Е1)) • (Ar(Е2)/ω2), следовательно
x:y=ω1/Ar(Е1): ω2/Ar(Е2)
Задание 6
В Средние века из золы костра выделяли вещество, которое называли поташ и использовали для варки мыла. Массовые доли элементов в этом веществе составляют: калий – 56,6%, углерод – 8,7%, кислород – 34,7%. Определите формулу поташа.
Дано: вещество KxCyOz, ω(K)=56,6% или 0,566, ω(C)=8,7%, или 0,087, ω(O)=34,7%, или 0,347
Найти: формулу KxCyOz-?
Решение
1-й способ
Находим соотношение атомов калия, углерода и кислорода в веществе как деление числовых значений массовых долей химических элементов, входящих в состав данного вещества, на их относительные атомные массы:
х:у:z=ω(K)/Ar(K) : ω(C)/Ar(C) : ω(O)/Ar(O)=0,566/39:0,087/12:0,347/16=0,0145:0,0073:0,0216
Если соотношение между атомами выражено не целыми, а дробными числами, то считаем, что меньшее число (0,0073) равно единице и большее число делим на него:
х:у:z=0,0145/0,0073 : 0,0073/0,0073 : 0,0216/0,0073=2:1:3, следовательно, формула имеет вид K2CO3
2-й способ
В 100 г вещества масса атомов калия составляет 56,6 г, атомов углерода ― 8,7 г, а атомов кислорода ― 34,7 г. Рассчитываем соотношение индексов в формуле (соотношение количества вещества элементов):
х:у:z=n(K):n(C):n(O)=m(K)/M(K) : m(C)/M(C) : m(O)/M(O)=56,6/39 : 8,7/12: 34,7/16=1,45:0,725:2,168
Если соотношение между атомами выражено не целыми, а дробными числами, то считаем, что меньшее число (0,725) равно единице и большее число делим на него:
х:у:z=1,45/0,725 : 0,725/0,725 : 2,168/0,725=2:1:3, следовательно, формула имеет вид K2CO3
Ответ: K2CO3
Похожие новости
Комментарии
Часто задаваемые вопросы
Для чего создан сайт?
Чтобы помочь ученикам.
У вас нет ГДЗ для моего учебника (
Это не проблема. Напиши нам чего нет и мы добавим.
Как с вами связатся?
Через почту: admin@gdz.cool или обратную связь.
Вам можно предложить учебник для ГДЗ?
Да. Отправь учебник на электронную почту, чтобы мы его решили.
В каком классе вы учитесь?
Социальные сети