ГДЗ (ответы) Химия 10 класc Габриелян О.С. , Остроумов И.Г., Сладков С.А., 2019, §14 Альдегиды и кетоны
Во всех упражнениях красным цветом приводится решение, а фиолетовым ― объяснение. |
Альдегидами называют вещества, в молекулах которых альдегидная группа связана с углеводородным радикалом (или атомом водорода).
Приведите формулы и названия трёх первых представителей этого гомологического ряда.
метаналь (формальдегид) | этаналь (уксусный альдегид) | пропаналь (пропионовый альдегид) |
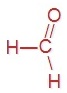 | 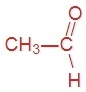 | 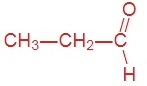 |
Даны молекулярные формулы веществ: C2H6O, C3H6O, CH2O, C2H4O2, C3H8O, C2H4O. Какие из этих формул могут отражать состав альдегидов? C3H6O, CH2O, C2H4O2
Общая формула представителей гомологического ряда альдегидов CnH2nO, поэтому состав альдегидов могут отражать формулы CH2O, или HCHO ― метаналь; C2H4O, или CH3CHO ― этаналь; C3H6O , или C2H5CHO ― пропаналь.
Напишите соответствующие структурные формулы.
метаналь | этаналь | пропаналь |
 |  | 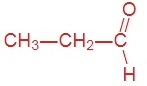 |
Формальдегид объёмом 44,8 л (н.у.) растворили в 240 г воды. Рассчитайте массовую долю альдегида в растворе.
Дано: V(HCHO)=44,8 л, m(H2O)=240 г
Найти: ω(HCHO)-?
Решение
1. Вычисляем количество вещества формальдегида объёмом 44,8 л по формуле: n=V/VM, где VM ― молярный объём.
n(HCHO)=V(HCHO):VM=44,8 л : 22,4 л/моль=2 моль
2. Вычисляем массу формальдегида количеством вещества 2 моль по формуле: m=n•M, где M ― молярная масса.
Mr(HCHO)=30, поэтому M(HCHO)=30 г/моль
m(HCHO)=n(HCHO)•M(HCHO)=2 моль • 30 г/моль=60 г
3. Рассчитываем массу раствора:
m(раствора)=m(HCHO)+m(воды)=60 г + 240 г=300 г
4. Рассчитываем массовую долю альдегида в растворе:
ω(HCHO)=(m(HCHO)/m(р-ра))•100%=(60 г : 300 г)•100%=20%
Ответ: 20%
Задание 4
При сжигании 0,22 г органического вещества, плотность паров которого по воздуху равна 1,517, образовалось 224 мл оксида углерода (IV) (н. у.) и 0,18 г воды. Определите молекулярную формулу вещества.
Известно: органическое вещество, Dвоздуха(вещества)=1,517, V(СО2)=224 мл=0,224 л, m(H2O)=0,18 г
Найти: формулу вещества - ?
Решение
1. Вычисляем количество вещества оксида углерода (IV) объёмом 0,224 л по формуле: n=V/VM, где VM― молярный объём.
n(CO2)=V(CO2)/VM=0,224 л : 22,4 л/моль=0,01 моль
2. При сгорании органического вещества все атомы водорода переходят в молекулы воды, а все атомы углерода ― в молекулы оксида углерода (IV). Вычисляем массу атомов углерода в 0,01 моль оксида углерода (IV).
В 1 моль СО2 содержится 12 г С, а
в 0,01 моль СО2 ― х г С
х=m(C)=0,01 моль • 12 г : 1 моль=0,12 г
3. Вычисляем массу атомов водорода в 0,18 г воды.
В 18 г Н2О содержится 2 г Н, а
в 0,18 г Н2О ― х г Н
у=m(Н)=0,18 г • 2 г : 18 г = 0,02 г
4. Сумма масс атомов углерода и водорода 0,12 г + 0,02 г=0,14 г, что меньше начальной массы вещества. То есть в органическом веществе еще содержится кислород массой: 0,22 г - 0,14 г = 0,08 г и общая формула вещества имеет вид: СхНуОz
5. Находим соотношение атомов в веществе c общей формулой СхНуОz:
х:у:z=m(C)/M(C) : m(H)/M(H) : m(O)/M(O)=0,12/12 : 0,02/1 : 0,08/16=0,01:0,02:0,005
Если соотношение между атомами выражено не целыми, а дробными числами, то считаем, что наименьшее число (0,005) равно единице, а большее число делим на него, тогда
х:у:z=0,01/0,005 : 0,02/0,005 : 0,005/0,005=2:4:1
Следовательно, простейшая формула вещества C2H4O, ей соответствует молярная масса М=44 г/моль.
Сравниваем с молярной массой органического вещества:
M(вещества)=M(воздуха)•Dвоздуха(вещества)= 29 г/моль •1,517=44 г/моль
Молярные массы совпадают, следовательно, определенная простейшая формула является молекулярной.
Ответ: C2H4O, или CH3CHO
Задание 5
В чём различие реакций полимеризации и поликонденсации?
В реакции поликонденсации, в отличие от реакции полимеризации, помимо высокомолекулярного вещества, образуется побочный низкомолекулярный продукт (чаще всего вода).
Ответ проиллюстрируйте уравнениями реакций полимеризации этилена и поликонденсации фенола с формальдегидом.
nCH2=CH2 ⟶ (―CH2―CH2―)n
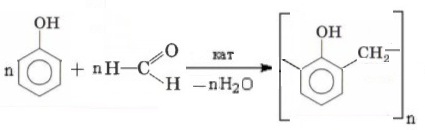
Задание 6
В двух пробирках без этикеток находятся растворы этиленгликоля и уксусного альдегида. Как при помощи растворов сульфата меди (II) и гидроксида натрия распознать предложенные вещества? Укажите признаки реакций.
Используя растворы сульфата меди (II) и гидроксида натрия, получим гидроксид меди (II):
CuSO4 + 2NaOH ⟶ Na2SO4 + Cu(OH)2↓
При добавлении свежеполученного гидроксида меди (II) в две пробирки с растворами наблюдается растворение гидроксида меди (II) и окрашивание растворов в ярко-синий цвет, а при последующем нагревании содержимого пробирок только в пробирке с раствором уксусного альдегида (в щелочной среде) будет наблюдаться изменение цвета на кирпично-красный из-за образовавшегося в результате реакции оксида меди (I):
C2H4(OH)2 + Cu(OH)2↓ ⟶ комплекс ярко-синего цвета.
2CH3CHO + 2Cu(OH)2↓ t⟶ 2CH3COOH + 2H2O + Cu2O↓ (кирпично-красного цвета)
Задание 7
Какая масса серебра образуется на стенках пробирки при взаимодействии 15 г 2%-ного раствора формальдегида с избытком аммиачного раствора оксида серебра?
Дано: m(раствора)=15 г, ω(HCHO)=2%
Найти: m(Ag)—?
Решение
1. Рассчитываем массу формальдегида в растворе:
m(HCHO)=ω(HCHO)•m(раствора):100%=2%•15 г:100%=0,3 г
2. Количество вещества формальдегида рассчитываем по формуле: n=m/M, где M ― молярная масса.
M(HCHO)=30 г/моль
n(HCHO)=m(HCHO)/M(HCHO)=0,3 г : 30 г/моль=0,01 моль
3. Составим химическое уравнение:
HCHO + Ag2Oаммиачный р-р t⟶ HCOOH + 2Ag↓
По уравнению реакции n(HCHO):n(Ag)=1:2, поэтому:
n(Ag)=2•n(HCHO)=2•0,01 моль=0,02 моль
4. Рассчитываем массу серебра количеством вещества 0,02 моль по формуле: m=n•M, где M ― молярная масса.
M(Ag)=108 г/моль
m(Ag)=n(Ag)•M(Ag)=0,02 моль • 108 г/моль=2,16 г
Ответ: 2,16 г серебра.
Задание 8
В 1860 г французский химик М. Бертло провёл реакцию ацетилена с водой и был уверен, что получил непредельный спирт: HC≡CH + H2O ⟶ CH2=CH–OH В 1877 г аналогичную реакцию осуществил русский химик Александр Павлович Эльтеков. Учёный пришёл к выводу, что получил уксусный альдегид: HC≡CH + H2O ⟶ CH3CHO Кто из учёных оказался прав? Александр Павлович Эльтеков, т.к. непредельный виниловый спирт неустойчив и в конечном случае превращается в уксусный альдегид.
Похожие новости
Комментарии
Часто задаваемые вопросы
Для чего создан сайт?
Чтобы помочь ученикам.
У вас нет ГДЗ для моего учебника (
Это не проблема. Напиши нам чего нет и мы добавим.
Как с вами связатся?
Через почту: admin@gdz.cool или обратную связь.
Вам можно предложить учебник для ГДЗ?
Да. Отправь учебник на электронную почту, чтобы мы его решили.
В каком классе вы учитесь?
Социальные сети