ГДЗ Химия 9 класc Габриелян О.С. , Остроумов И.Г., Сладков С.А. 2019 §12 СОЕДИНЕНИЯ ГАЛОГЕНОВ
Красным цветом приводится решение, а фиолетовым ― объяснение. |
Как получают галогеноводороды в промышленности и лаборатории?
Галогеноводороды в промышленности получают прямым синтезом из простых веществ:
H2 + F2 = 2HF
H2 + Cl2 = 2HCl
Фтороводород и хлороводород в лаборатории обычно получают воздействием концентрированной серной кислотой на их галогениды щелочных металлов:
CaF2 + H2SO4(конц.) = CaSO4 + 2HF↑
2NaCl + H2SO4(конц.) = Na2SO4 + 2HCl↑
Для получения иодоводорода и бромоводорода используют кислоты, не обладающие окислительными свойствами:
КI (тв) + Н3РO4(конц.) = КН2РO4 + HI↑
КВr(тв) + Н3РO4(конц.) = КН2РO4 + HB↑
Как изменяется скорость синтеза галогеноводородов в зависимости от природы галогена? Скорость синтеза галогеноводородов тем больше, чем более электроотрицателен галоген. Так, например, реакция фтора с водородом протекает со взрывом, а реакция иода с водородом — только при нагревании и является обратимой.
Задание 2
Каков состав высших оксидов галогенов и какими свойствами они обладают?
В высших оксидах галогены проявляют степень окисления +7 — общая формула Г2O7(кроме фтора, т.к. это самый электроотрицательный элемент и положительных степеней окисления не проявляет). Высшие оксиды галогенов обладают кислотными свойствами.
Реагируют с водой:
Cl2O7 + H2O = 2HClO4
Реагируют с основными оксидами:
Na2O + Cl2O7 = 2NaClO4
Реагируют с щелочами:
2NaOH + Cl2O7 = 2NaClO4 + H2O
Можно ли получить эти оксиды синтезом? Можно, например, 2HClO4 + P2O5 = Cl2O7 + 2HPO3
Задание 3
С помощью какого реактива можно распознать галогенид-ионы? Реактив качественной реакции — раствор нитрата серебра.
Ag+ + Cl− ⟶ AgCl↓ — осадок белый творожистый
Аg+ + Br− ⟶ AgBr↓ — осадок светло-желтый
Ag+ + Br−⟶ AgBr↓ — осадок желтый
Какой ион является исключением? Фторид-ион
Как его распознают? С помощью растворимой соли кальция: Ca2+ + 2F− ⟶ CaF2↓ — осадок белый
Задание 4
Составьте схему образования химической связи для молекул галогеноводородов.
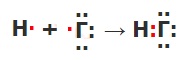
Как меняется их полярность связи и прочность молекулы от НF к НI? Полярность связи от HF к HI уменьшается, т. к. в этом ряду уменьшается электроотрицательность галогенов. Прочность молекулы уменьшается, т.к. в этом ряду увеличивается длина связи Н—Г (поскольку растёт радиус атома галогена).
Задание 5
Дайте сравнительную характеристику галогеноводородных кислот. Укажите черты сходства и различия. Сравнение химических свойств проиллюстрируйте уравнениями химических реакций.
Сходства химических свойств галогеноводородных кислот:
1) реагируют с металлами:
Zn+ 2HCl = ZnCl2 + H2↑
Zn+ 2HBr = ZnBr2 + H2↑
2) реагируют с основными оксидами:
MgO + 2HСl = MgCl2 + H2O
MgO + 2HF = MgF2 + H2O
3) реагируют с основаниями:
Mg(OH)2 + 2HBr = MgBr2 + 2H2O
Mg(OH)2 + 2HCl = MgCl2 + 2H2O
4) реагируют с солями, если образуется газ или осадок:
2HF + Ca(NO3)2 = 2HNO3 + CaF2↓
HI + AgNO3 = HNO3 + AgI↓
Различия химических свойств галогеноводородных кислот.
В ряду HF—НСl—НВг—HI растёт сила кислот, то есть средней силы плавиковая кислота HF, в отличие от остальных сильных кислот, обладает необычным свойством: она способна реагировать с оксидом кремния (IV):
4HF + SiO2 = SiF4 + 2Н2O
Задание 6
В четырёх пробирках без этикеток находятся растворы фторида, хлорида, бромида и иодида натрия. Как с помощью одного реактива распознать эти вещества? Распознать галогенид-ионы можно с помощью нитрата серебра: в пробирке с раствором хлорида натрия образуется белый творожистый осадок, в пробирке с раствором бромида натрия — светло-желтый осадок, в пробирке с раствором иодида натрия — желтый осадок, а в пробирке с раствором фторида натрия — осадок не образуется, т. к. фторид серебра является растворимым соединением.
Напишите уравнения реакций.
NaCl + AgNO3 ⟶ NaNO3 + AgCl↓ — белый творожистый осадок
Na+ + Cl- + Ag+ + NO3- ⟶ Na+ + NO3- + AgCl↓
Ag+ + Cl- ⟶ AgCl↓
NaBr + AgNO3 ⟶ NaNO3 + AgBr↓ — cветло-желтый осадок
Na+ + Br- + Ag+ + NO3- ⟶ Na+ + NO3- + AgBr↓
Ag+ + Br- ⟶ AgBr↓
NaI + AgNO3 ⟶ NaNO3 + AgI↓ — желтый осадок
Na+ + I- + Ag+ + NO3- ⟶ Na+ + NO3- + AgI↓
Ag+ + I- ⟶ AgI↓
Задание 7
Используя метод электронного баланса, составьте уравнения реакций, соответствующие следующим схемам превращений, укажите окислители и восстановители:
а) Fe2(SO4)3 + KI ⟶ FeSO4 + I2 + K2SO4;
Fe2(SO4)3 + 2KI = 2FeSO4 + I2 + K2SO4
Схема окислительно-восстановительной реакции.
Fe2+3(SO4)3 + KI-1 ⟶ Fe+2SO4 + I20 + K2SO4
2I-1 -2ē ⟶ I20 |2|2|1 ― процесс окисления
Fe+3 +1ē ⟶ Fe+2 |1| |2 ― процесс восстановления
Проводим вертикальную черту и пишем за ней число электронов, которые отдали и присоединили атомы иода и железа. Находим наименьшее общее кратное для чисел 2 и 1. Это число 2, которое записываем за второй вертикальной чертой посередине, и поделив его поочередно на 2 и 1, записываем результат за третьей чертой в строках, касающихся элементов иода и железа. Множители 1 и 2 являются искомыми коэффициентами. Поскольку элементы изменили степень окисления полностью (в правой части схемы эти элементы ни в одном веществе не проявляют такую же степень окисления, как в исходном веществе) и разными являются индексы элементов в формуле исходного вещества и продукта реакции, поэтому ставим коэффициент 1 (который обычно не пишем), поскольку относится к двум атомам иода, перед формулой иода I2 и коэффициент 2, поскольку относится к одному атому железа, перед формулой сульфата железа FeSO4. Подбираем коэффициенты для остальных соединений.
В приведённой реакции иодид калия— восстановитель (за счёт атомов иода в степени окисления -1), а сульфат железа (III) (за счёт атомов железа в степени окисления +2) — окислитель.
б) NaBr + Cl2 ⟶ NaCl + Br2;
2NaBr + Cl2 = 2NaCl + Br2
Схема окислительно-восстановительной реакции.
NaBr-1 + Cl20 ⟶ NaCl-1 + Br20
2Br-1 -2ē ⟶ Br20 |2|2|1 ― процесс окисления
Cl20 + 2ē ⟶ 2Cl-1 |2| |1 ― процесс восстановления
Проводим вертикальную черту и пишем за ней число электронов, которые отдали и присоединили атомы брома и хлора. Находим наименьшее общее кратное для чисел 2 и 2. Это число 2, которое записываем за второй вертикальной чертой посередине, и поделив его поочередно на 2 и 2, записываем результат за третьей чертой в строках, касающихся элементов брома и хлора. Множители 1 и 1 являются искомыми коэффициентами. Поскольку элементы изменили степень окисления полностью (в правой части схемы эти элементы ни в одном веществе не проявляют такую же степень окисления, как в исходном веществе) и разными являются индексы элементов в формуле исходного вещества и продукта реакции, поэтому ставим коэффициент 1 (который обычно не пишем), поскольку относится к двум атомам, перед формулой брома Br2 и хлора Cl2. Подбираем коэффициенты для остальных соединений.
В приведённой реакции бромид натрия — восстановитель (за счёт атомов брома в степени окисления -1), а хлор — окислитель.
в) KBr + MnO2 + H2SO4 ⟶ Br2 + K2SO4 + MnSO4 + H2O
2KBr + MnO2 + 2H2SO4 = Br2 + K2SO4 + MnSO4 + 2H2O
Схема окислительно-восстановительной реакции.
KBr-1 + Mn+4O2 + H2SO4 ⟶ Br20 + K2SO4 + Mn+2SO4 + H2O
2Br-1 -2ē ⟶ Br20 |2|2|1 ― процесс окисления
Mn+4 +2ē ⟶ Mn+2 |2| |1 ― процесс восстановления
Проводим вертикальную черту и пишем за ней число электронов, которые отдали и присоединили атомы брома и марганца. Находим наименьшее общее кратное для чисел 2 и 2. Это число 2, которое записываем за второй вертикальной чертой посередине, и поделив его поочередно на 2 и 2, записываем результат за третьей чертой в строках, касающихся элементов брома и марганца. Множители 1 и 1 являются искомыми коэффициентами. Поскольку элементы изменили степень окисления полностью (в правой части схемы эти элементы ни в одном веществе не проявляют такую же степень окисления, как в исходном веществе) и одинаковыми являются индексы элемента марганца в формуле исходного вещества и продукта реакции, поэтому ставим коэффициент 1 (который обычно не пишем) перед формулой двух соединений марганца (MnO2, MnSO4), а разными являются индексы элемента брома в формуле исходного вещества и продукта реакции, поэтому ставим коэффициент 1, поскольку относится к двум атомам брома, перед формулой брома Br2. Подбираем коэффициенты для остальных соединений.
В приведённой реакции бромид калия (за счёт атомов брома в степени окисления -1) — восстановитель , а оксид марганца (IV) (за счёт атомов марганца в степени окисления +4) — окислитель.
Задание 8
При обработке 5,30 г смеси хлорида натрия и карбоната натрия избытком соляной кислоты выделилось 784 мл газа (н.у.). Рассчитайте массовые доли компонентов в смеси.
Дано: m(смеси)=5,30 г; в смеси соединений только карбонат натрия реагирует из соляной кислотой с образованием углекислого газа, поэтому V(СО2)=784 мл=0,784 л
Найти: w(Na2CO3)-?, w(NaCl)-?
Решение
1 способ
1. Количество вещества углекислого газа объёмом 0,784 л рассчитываем по формуле: n=V/VM, где VM=22,4 л/моль.
n(CO2)=V(CO2)/VM=0,784 л : 22,4 л/моль=0,035 моль
2. Составим химическое уравнение:
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
По уравнению реакции n(Na2CO3):n(CO2)=1:1, количества веществ одинаковые, поэтому:
n(Na2CO3)=n(СО2)=0,035 моль
3. Вычисляем массу карбоната натрия количеством вещества 0,035 моль по формуле: m=n•M, где M — молярная масса.
Mr(Na2CO3)=2•Ar(Na)+Ar(C)+3•Ar(O)=2•23+12+3•16=106, поэтому M(Na2CO3)=106 г/моль
m(Na2CO3)=n(Na2CO3)•M(Na2CO3)=0,035 моль •106 г/моль=3,71 г
4. Вычисляем массовую долю карбоната натрия в смеси:
w(Na2CO3)=(m(Na2CO3):m(смеси))•100%=(3,71 г : 5,30 г)•100%=70%
5. Вычисляем массовую долю хлорида натрия в смеси:
w(Na2CO3)=100%-w(Na2CO3)=100%-70%=30%
2 способ
1. Составим химическое уравнение:
х г 0,784 л
Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O
106 г 22,4 л
Над формулами соединений Na2CO3 и CO2 записываем неизвестную массу cоли (х г) и приведенный в условии задачи объём углекислого газа (0,784 л), а под формулами соединений ― массу и объём соответствующего количества вещества согласно коэффициентам в химическом уравнении. При н.у. 1 моль любого газа занимает объём 22,4 л.
Mr(Na2CO3)=2•Ar(Na)+Ar(C)+3•Ar(O)=2•23+12+3•16=106, поэтому M(Na2CO3)=106 г/моль. Масса 1 моль=106 г
х=m(Na2CO3)=106 г • 0,784 л : 22,4 л=3,71 г
2. Вычисляем массовую долю карбоната натрия в смеси, то есть массу карбоната натрия в 100 г смеси:
в 5,30 г смеси содержится 3,71 г Na2CO3, а
в 100 г смеси ― х г Na2CO3
х=3,71 г • 100 г : 5,30 г=70 г, то есть w(Na2CO3)=70%
4. Вычисляем массовую долю хлорида натрия в смеси:
w(Na2CO3)=100%-w(Na2CO3)=100%-70%=30%
Ответ: w(Na2CO3)=70%, w(NaСl)=30%
Задание 9
Молярная масса бромида одновалентного металла на 31% больше, чем молярная масса хлорида этого металла. Что это за металл?
Допустим, что молярная масса M(MeCl) составляет 100%,
тогда по условию задачи M(MeBr) будет составлять 131%.
M(MeBr) : M(MeCl) = 131% : 100%, отсюда по свойству пропорции имеем
M(MeBr) • 100% = M(MeCl) • 131%, поэтому
M(MeBr)=M(MeCl) • 131% : 100%
M(MeBr)=1,31•M(MeCl), поэтому Mr(MeBr)=1,31•Mr(MeCl) (1).
Примем Ar(Me)=х, тогда
Mr(MeBr)=Ar(Me)+Ar(Br)=х+80
Mr(MeСl)=Ar(Me)+Ar(Cl)=х+35,5
и подставим значения в формулу (1), получим алгебраическое уравнение и решим его:
х+80=1,31•(х+35,5)
х+80=1,31х+46,505
1,31х - х = 80 - 46,505
0,31х=33,495
х=33,495:0,31
х=108, то есть Ar(Me)=108. Такую относительную атомную массу имеет металлический одновалентный элемент — серебро Ag
Ответ: серебро
Дополнительное задание
Объём производства соляной кислоты в России составляет 1 млн т в год. Сравните эти данные с объёмом производства соляной кислоты в трёх-четырёх других странах. Результат представьте в виде диаграммы в координатах: объём производства (млн т) — страна. Самостоятельно.
Похожие новости
Комментарии
Часто задаваемые вопросы
Для чего создан сайт?
Чтобы помочь ученикам.
У вас нет ГДЗ для моего учебника (
Это не проблема. Напиши нам чего нет и мы добавим.
Как с вами связатся?
Через почту: admin@gdz.cool или обратную связь.
Вам можно предложить учебник для ГДЗ?
Да. Отправь учебник на электронную почту, чтобы мы его решили.
В каком классе вы учитесь?
Социальные сети