ГДЗ Химия 9 класc Габриелян О.С. , Остроумов И.Г., Сладков С.А. 2019 §1 КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ СОЕДИНЕНИЙ ответы
Красным цветом приводится решение, а фиолетовым ― объяснение. |
Какие соединения называются бинарными? Соединения, образованные атомами двух химических элементов.
Какие бинарные соединения называются оксидами? Оксиды ― бинарные соединения, образованные атомами двух химических элементов, один из которых ― кислород.
На какие группы делятся оксиды? Приведите примеры оксидов каждой группы. Оксиды делятся на несолеобразующие и солеобразующие (основные, амфотерные и кислотные).
Схема
Несолеобразующие | Солеобразующие оксиды | ||
оксид углерода (II) СО оксид азота (II) NO оксид азота (I) N2O оксид кремния (II) SiO | основные оксиды | амфотерные оксиды | кислотные оксиды |
оксид натрия Na2O оксид меди (II) CuO | оксид цинка ZnO оксид алюминия Al2O3 | оксид углерода (IV) CO2 оксид серы (VI) SO3 | |
Солеобразующими называют оксиды, которые взаимодействуют с кислотами или щелочами с образованием соли и воды.
Кислотные оксиды ― солеобразующие оксиды, образованные атомами неметалла и кислорода.
Основные оксиды ― солеобразующие оксиды, образованные атомами металла и кислорода.
Амфотерные оксиды ― оксиды, образованные атомами кислорода и амфотерного элемента.
Задание 2
Какие соединения называются гидроксидами? Гидроксиды — это продукты прямого или косвенного соединения оксидов с водой.
Какие гидроксиды называются основаниями? Сложные вещества, состоящие из ионов металла и гидроксогрупп, называются основаниями.
На какие группы делятся основания? На растворимые в воде основания (щёлочи) и нерастворимые основания.
Приведите примеры оснований каждой группы.
Растворимые основания (щёлочи): гидроксид лития LiOH, гидроксид натрия NaOH, гидроксид калия KOH, гидроксид бария Ba(OH)2.
Нерастворимые основания: гидроксид меди (II) Cu(OH)2, гидроксид железа (II) Fe(OH)2, гидроксид железа (III) Fe(OH)3, гидроксид цинка Zn(OH)2, гидроксид алюминия Al(OH)3.
Задание 3
Какие соединения называются кислотами? Кислоты — это сложные соединения, молекулы которых состоят из атомов водорода и кислотного остатка.
На какие группы делятся кислоты? На кислородсодержащие и бескислородные.
Приведите примеры кислот каждой группы.
Кислородсодержащие кислоты: азотная кислота HNO3, азотистая кислота HNO2, сернистая кислота H2SO3, серная кислота H2SO4, фосфорная кислота H3PO4, угольная кислота H2CO3, кремниева кислота H2SiO3.
Бескислородные: хлороводородная кислота HCl, фтороводородная кислота HF, бромоводородная кислота HBr, иодоводородная кислота HI, сероводородная кислота H2S.
Задание 4
Какие соединения называются солями? Солями называют соединения, которые состоят из ионов металлов (или аммония NH4+) и ионов кислотного остатка. При этом анион может представлять кислотный остаток как кислородсодержащей кислоты (NO3-, SO42-), так и бескислородной (например, Cl-, S2-).
На какие группы делятся соли? На средние, кислые, основные и комплексные соли.
Приведите примеры солей каждой группы.
Средние соли: сульфат калия К2SO4, карбонат натрия Na2CO3.
Продукт полного замещения атомов водорода кислоты на металл.
Кислые соли: гидросульфат калия КHSO4, гидрокарбонат натрия NaHCO3.
Продукт неполного замещения атомов водорода кислоты на металл.
Основные соли: гидроксохлорид магния MgОHСl, гидроксонитрат цинка Zn(ОH)NO3.
Продукт неполного замещения гидроксогрупп в основаниях или амфотерных гидроксидах кислотным остатком.
Комплексные соли: тетрагидроксоалюминат натрия Nа[Аl(ОН)4], гексацианоферрат калия (IV) К4[Fе(СN)6].
Состоят из простого иона и сложного (комплексного) иона, который в формулах заключается в квадратные скобки.
Задание 5
Как зависит характер оксидов и гидроксидов химического элемента от значения степени окисления?
Оксиды и гидроксиды металлов IА и IIА (начиная с кальция) групп — щёлочных и щёлочноземельных, а также некоторых других металлов в низших степенях окисления имеют основной характер. Амфотерные гидроксиды характерны для оксидов и гидроксидов металлов, как правило, в степенях окисления +2, +3, +4. Оксиды и кислородсодержащие кислоты, которые образуют неметаллы и металлы в высших степенях окисления (+5, + 6, +7) имеют кислотный характер.
Приведите примеры.
| Основной характер: | Амфотерный характер: | Кислотный характер: |
| Na2+1О — оксид натрия Na+1ОН — гидроксид натрия Cu+2O – оксид меди (II) Cu+2(OH)2 – гидроксид меди (II) | Zn+2О — оксид цинка Zn+2(ОН)2 — гидроксид цинка Al2+3О3 — оксид алюминия Al+3(ОН)3 — гидроксид алюминия | СО2 – оксид углерода (IV) Н2С+4О3 – угольная кислота Cr+6O3 – оксид хрома (VI) H2Cr+6O4 – хромовая кислота |
Задание 6
Составьте в электронном виде обобщённую схему классификации веществ по составу, объединив схемы 2—4. Распечатайте полученную схему. Используйте схему для определения принадлежности веществ к тому или иному классу.
Классификация веществ по составу
Оксиды | Гидроксиды | Соли | ||||||||
| несолеобзарующие | солеобразующие | основания | амфотерные гидроксиды | кислородсодер- жащие кислоты | средние | кислые | осно́вные | комплек-сные. | ||
| основные | амфотерные | кислотные | ||||||||
Задание 7
Распределите перечисленные ниже формулы на четыре группы: Na2SO4, НI, V2O5, KMnO4, Co(OH)2, H2CrO4, NiO, CsOH, (NH4)2Cr2O7, Ca(OH)2, Cl2O, HCN. Дайте названия всем веществам.
| Оксиды | Основания | Кислоты | Соли |
| V2O5 оксид ванадия (V) NiO оксид никеля (II) Cl2O оксид хлора (I) | Co(OH)2 гидроксид кобальта (II) CsOH гидроксид скандия (I) Ca(OH)2 гидроксид кальция | HI иодоводородная кислота H2CrO4 хромовая кислота HCN синильная кислота | Na2SO4 сульфат натрия KMnO4 перманганат калия (NH4)2Cr2O7 дихромат аммония |
Задание 8
Приведите формулы веществ, подходящих к схемам и укажите характер каждого гидроксида. Назовите соли:
а) оксид натрия → гидроксид → соль;
Na2O → NaOH основный → NaCl (хлорид натрия)
б) оксид цинка → гидроксид → соль;
ZnO → Zn(OH)2 амфотерный→ NaCl (хлорид натрия)
в) оксид азота (V) → гидроксид → соль.
N2O5 → HNO3 кислотный → NaNO3 (нитрат натрия)
Задание 9
Воспользовавшись схемой, составленной при выполнении задания 1, приведите примеры известных вам соединений каждого класса в различных агрегатных состояниям. Совместно с учителем обсудите, в каждом ли классе веществ есть представители, находящиеся при нормальных условиях в газообразном, жидком и твёрдом состояниях.
| Класс | Формула | Агрегатное состояние |
| Оксиды | H2O CO2 CaO | жидкое газообразное твердое |
| Гидроксиды | NaOH HNO3 | твердое жидкое (летучая "дымит" на воздухе) |
| Соли | CaCO3 NaCl | твердое твердое |
Дополнительное задание
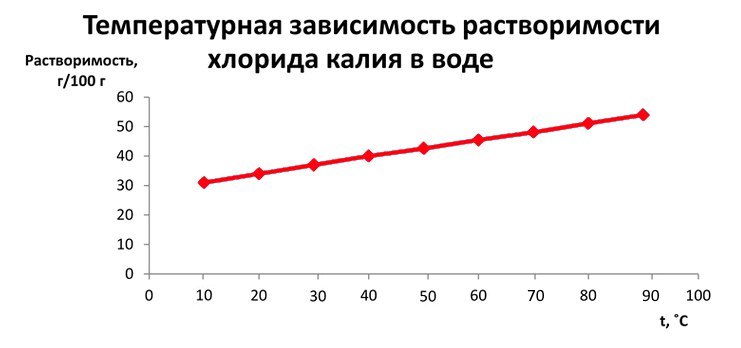
Вопрос 1. Растворимость веществ в воде зависит от температуры. Твёрдые вещества, как правило, при нагревании растворяются лучше, газообразные — наоборот. Данные о зависимости растворимости от температуры можно найти в справочниках. Например, для хлорида калия справочные данные таковы.
| Растворимость г/100 г | 31 | 34 | 37 | 40 | 42,6 | 45,5 | 48,1 | 51,1 | 54 |
| Температура t0C | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
Вопрос 2. Исследуемые вещества в порядке увеличения растворимости в воде при комнатной температуре: ванилин, питьевая сода, поваренная соль, лимонная кислота,, сахар
Похожие новости
Комментарии
Часто задаваемые вопросы
Для чего создан сайт?
Чтобы помочь ученикам.
У вас нет ГДЗ для моего учебника (
Это не проблема. Напиши нам чего нет и мы добавим.
Как с вами связатся?
Через почту: admin@gdz.cool или обратную связь.
Вам можно предложить учебник для ГДЗ?
Да. Отправь учебник на электронную почту, чтобы мы его решили.
В каком классе вы учитесь?
Социальные сети