ГДЗ Химия 11 класc Рудзитис Г.Е. Фельдман Ф.Г. §11 Причины многообразия веществ РЕШЕБНИК ОТВЕТЫ
Красным цветом приводится решение, а фиолетовым ― объяснение. |
Перечислите причины многообразия веществ. Гомология, изомерия, полиморфизм.
Задание 2
Как вы докажете, что красный и белый фосфор представляют собой две аллотропные разновидности одного и того же элемента? Красный фосфор при сильном нагревании в бескислородной среде превращается в белый фосфор, то есть красный и белый фосфор являются аллотропными разновидностями одного и того же элемента.
Задание 3
Составьте электронную схему "Виды изомерии органических соединений", иллюстрируя её конкретными примерами. Обсудите результат с соседом по парте.
Изомерия углеродного скелета:
CH3―CH2―CH2―CH3 н-бутан
CH3―CH(CH3)―CH3 2-метилпропан
Изомерия положения кратной связи:
CH2=CH―CH2―CH3 бутен-1
CH3―CH=CH―CH3 бутен-2
Изомерия положения функциональной группы:
CH3―CH2―CH2―OH пропанол-1
CH3―CH(OH)―CH3 пропанол-2
Межклассовая изомерия:
H2C=CH―CH=CH2 1,3-бутадиен
HC≡C―CH2―CH3 бутин
Цис-транс-изомерия:
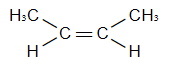
цис-бутен-2
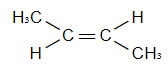
транс-бутен-2
Задание 4
Приведите формулы трех гомологов углеводородов, относящихся к гомологическому ряду с обшей формулой CnH2n. Дайте им названия.
CH2=CH―CH3 пропен
CH2=CH―CH2―CH3 бутен-1
CH2=CH―CH2―CH2―CH3 пентен-1
Задание 5
К раствору, содержащему 12,6 г азотной кислоты, добавили раствор содержащий 7,2 г гидроксида натрия. Сколько соли при этом образуется? Какое вещество останется в избытке? Какова его масса?
Дано: m(HNO3)=12,6 г, m(NaOH)=7,2 г
Найти: m(NaNO3)-?, mостатка(HNO3)-?
Решение
1. Количество вещества азотной кислоты и гидроксида натрия рассчитываем по формуле: n=m/M, где M ― молярная масса.
M(HNO3)=63 г/моль, M(NaOH)=40 г/моль
n(HNO3)=m(HNO3)/M(HNO3)=12,6 г : 63 г/моль=0,2 моль
n(NaOH)=m(NaOH)/M(NaOH)=7,2 г : 40 г/моль=0,18 моль
2. Составим химическое уравнение: HNO3 + NaOH = NaNO3 + H2O
По уравнению реакции n(HNO3)/1=n(NaOH)/1, подставив численные значения, получим 0,2/1>0,18/1, следовательно, азотная кислота в избытке, то есть реагирует не полностью, поэтому расчеты будем проводить по данным гидроксида натрия.
nостатка(HNO3)=0,2 - 0,18 моль=0,02 моль
По уравнению реакции n(NaOH)/1=n(NaNO3)/1, поэтому
n(NaNO3)=n(NaOH)=0,18 моль
3. Массу NaNO3 и остатка HNO3 рассчитываем по формуле: m=n•M.
M(NaNO3)=85 г/моль
m(NaNO3)=n(NaNO3)•M(NaNO3)=0,18 моль • 85 г/моль=15,3 г
mостатка(HNO3)=n(HNO3)•M(HNO3)=0,02 моль • 63 г/моль=1,26 г
Ответ: m(NaNO3)=15,3 г, mостатка(HNO3)=1,26 г
Похожие новости
Комментарии
Часто задаваемые вопросы
Для чего создан сайт?
Чтобы помочь ученикам.
У вас нет ГДЗ для моего учебника (
Это не проблема. Напиши нам чего нет и мы добавим.
Как с вами связатся?
Через почту: admin@gdz.cool или обратную связь.
Вам можно предложить учебник для ГДЗ?
Да. Отправь учебник на электронную почту, чтобы мы его решили.
В каком классе вы учитесь?
Социальные сети