ГДЗ Химия 11 класc Рудзитис Г.Е. Фельдман Ф.Г. §9 Пространственное строение молекул РЕШЕБНИК ОТВЕТЫ
Красным цветом приводится решение, а фиолетовым ― объяснение. |
Приведите примеры образования молекул органических и неорганических веществ на основе sp-, sp2- и sp3-гибридизации.
| Вещества | Тип гибридизации | ||
| sp-гибридизация | sp2-гибридизация | sp3-гибридизация | |
| Органические | этин HC≡CH | этен CH2=CH2 формальдегид H2C=O | метан CH4 этан CH3―CH3 |
| Неорганические | фторид бериллия BeF2 оксид углерода (IV) CO2 | хлорид бора BCl3 оксид серы (IV) SO2 | вода H2O аммиак NH3 |
Что общего у молекул метана, аммиака и воды и чем они различаются по строению?
Сходство состоит в том, что в молекулах метана CH4, аммиака NH3 и воды H2O центральные атомы находятся в состоянии sp3-гибридизации.
Различие состоит в том, что в молекуле метана в образовании связей участвуют все четыре гибридные орбитали атома углерода, в молекуле аммиака ― три гибридные орбитали атома азота (четвёртая заполнена неподелённой электронной парой), в молекуле воды ― две гибридные орбитали атома кислорода (две других заполнены неподелёнными электронными парами). В молекуле метана угол между связями приблизительно равен тетраэдрическому углу (109°28). Между орбиталями, участвующими в образовании связей, и орбиталями, занятыми свободными электронными парами, действуют силы отталкивания. Так как у атома азота одна такая пара, то угол отклонения от тетраэдрического небольшой и составляет 107,3°, а в атома кислорода их уже две, поэтому угол отклонения больше и составляет 104,5°.
Задание 3
Охарактеризуйте строение молекулы воды. Укажите вид связей, их количество, полярность. Как осуществляется перекрывание электронных орбиталей при образовании связей? Какую геометрическую форму имеет молекула?
Ковалентная связь образуется за счет двух неспаренных р-электронов атома кислорода и s-электрона каждого атома водорода, связи O―H являются полярными за счет более высокой электроотрицательности кислорода.
При образовании молекулы воды происходит гибридизация орбиталей атома кислорода по типу sp3, в результате перекрывания s-орбиталей атомов водорода с sр3-гибридными орбиталями атома кислорода, угол между связями H–O–H равен 104,5°. Отклонение от тетраэдрического угла (109°28') обусловлено действием неподелённых электронных пар: у атома кислорода связывающими электронными парами заняты только две sp3-гибридные орбитали, а две другие заполнены неподелёнными электронными парами.
Так как молекула воды имеет угловое строение и образована элементами с разной степенью электроотрицательности, то она является полярной.
Задание 4
Составьте структурную формулу четырёххлористого углерода. Определите вид химической связи в этом соединении, тип гибридизации орбиталей атома углерода и форму молекулы.
| Cтруктурная формула четырёххлористого углерода | Вид химической связи в соединении | Тип гибридизации орбиталей | Форма молекулы |
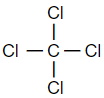 | ковалентная полярная (электронные пары смещены в сторону хлора) | sp3-гибридизация (угол между связями 109028') | 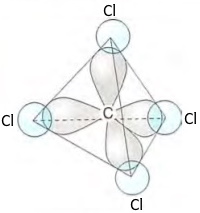 тетраэдрическая |
К 200 г раствора, содержащего 24% нитрата калия, добавили 800 мл воды. Определите массовую долю (в процентах) нитрата калия в полученном растворе.
Дано: m(раствора)=200 г, V(H2O)=800 мл, ω(KNO3)=24%
Найти: ω1(KNO3)-?
Решение
1. Вычислим массу воды:
m(H2O)=ρ(H2O)•V(H2O)=1 г/мл•800 мл=800 г
2. Вычислим массу нитрата калия в начальном растворе:
m(KNO3)=(ω(KNO3)•m(раствора)):100%=(24%•200 г):100%=48 г
3. Рассчитаем массу полученного раствора:
m1(раствора)=m(раствора)+m(Н2О)=200 г + 800 г=1000 г
4. Вычислим массовую долю нитрата калия в полученном растворе:
ω1(KNO3)=(m(KNO3)/m2(раствора))•100%=(48 г : 1000 г)•100%=4,8%
Ответ: 4,8%
Тест 1
sp3-гибридизацией можно объяснить геометрическую форму молекулы
1) NH3
2) Br2 молекула линейная Br–Br
3) C2H6
4) HBr молекула линейная H–Br
Тест 2
sp2-гибридизацией можно объяснить геометрическую форму молекулы
1) C2H4
2) BBr2
3) CH4 sp3-гибридизация
4) H2O sp3-гибридизация
Тест 3
sp-гибридизацией можно объяснить геометрическую форму молекулы
1) BCl3 sp2-гибридизация
2) BeF2
3) C2H2
4) C2H6 sp3-гибридизация
Похожие новости
Комментарии
Часто задаваемые вопросы
Для чего создан сайт?
Чтобы помочь ученикам.
У вас нет ГДЗ для моего учебника (
Это не проблема. Напиши нам чего нет и мы добавим.
Как с вами связатся?
Через почту: admin@gdz.cool или обратную связь.
Вам можно предложить учебник для ГДЗ?
Да. Отправь учебник на электронную почту, чтобы мы его решили.
В каком классе вы учитесь?
Социальные сети