ГДЗ Химия 10 класc Габриелян О.С. , Остроумов И.Г., Сладков С.А., 2019, §4 Непредельные углеводороды. Алкены РЕШЕБНИК ОТВЕТЫ
Красным цветом приводится решение, а фиолетовым ― объяснение. |
Какие углеводороды называют алкенами? Углеводороды, содержащие в молекулах одну двойную связь и имеющие общую формулу CnH2n, называют алкенами.
Приведите молекулярные и структурные формулы, а также названия алкенов, содержащих от двух до четырёх атомов углерода в молекуле.
| Молекулярная формула | Структурная формула | Название
|
| C2H4 | CH2=CH2 | этен |
| C3H6 | CH2=CH―CH3 | пропен |
| C4H8 | CH2=CH―CH2―CH3 CH3―CH=CH―CH3 | бутен-1 бутен-2 |
Какие виды изомерии характерны для этиленовых углеводородов? Ответ проиллюстрируйте примерами изомеров бутена.
| Виды изомерии | Примеры | Названия соединений |
| Изомерия углеродного скелета. | CH2=CH―CH2―CH3 | бутен-1 |
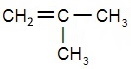 | 2-метилпропен | |
| Изомерия положения двойной связи | CH2=CH―CH2―CH3 CH3―CH=CH―CH3 | бутен-1 бутен-2 |
| Пространственная изомерия. | 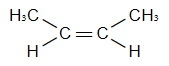 | цис-бутен-2 |
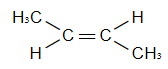 | транс-бутен-2 |
Охарактеризуйте промышленные и лабораторные способы получения алкенов. Напишите уравнение реакции дегидрирования алканов с использованием общих формул.
Промышленные способы.
Каталитический и термический крекинг (нагревание алканов без доступа воздуха в присутствии катализатора или при высокой температуре) предельных углеводородов нефти и попутного нефтяного газа. Цепь углеродных атомов разрывается примерно пополам, при этом образуются молекулы предельного и непредельного углеводородов:
C8H18 октанt→ C4H8 бутен + C4H10 бутан
Лабораторные способы.
Дегидратация спиртов (отщепление молекулы воды) при воздействии водоотнимающих средств (концентрированной серной кислоты, оксида алюминия) при нагревании:
C2H5OH t, H2SO4(конц.)→ C2H4 + H2O
Дегидрирование алканов (отщепление молекулы водорода) над катализаторами при высокой температуре:
CnH2n+2t, кат.→ CnH2n + H2
Задание 4
Для пропилена напишите уравнения реакций:
а) горения;
2CH3―CH=CH2 + 9O2 ⟶ 6CO2 + 6H2O
б) гидратации;
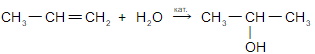
в) присоединения бромоводорода;
CH3―CH=CH2 + HBr ⟶ CH3―CHBr―CH3
г) гидрирования;
CH3―CH=CH2 + H2t,p,кат.⟶ CH3―CH2―CH3
д) бромирования.
CH3―CH=CH2 + Br2 ⟶ CH3―CHBr―CH2Br
Задание 5
Сравните этан и этилен по следующим признакам:
а) качественный и количественный состав;
Молекула этана состоит из 2 атомов углерода и 6 атомов водорода: C2H6.
Молекула этилена состоит из 2 атомов углерода и 4 атомов водорода: C2H4.
б) строение молекул;
В молекуле этана все атомы углерода находятся в состоянии sp2-гибридизации, все связи одинарные, молекула имеет форму тетраэдра.
В молекуле этилена атомы углерода, между которыми имеется двойная связь, находятся в состоянии sp2-гибридизации, двойная связь состоит из одной σ- и одной ?-связи, в молекуле все атомы расположены в одной плоскости.
в) химические свойства.
Реакция горения этана и этилена:
2CH3―CH3 + 7O2 ⟶ 4CO2 + 6H2O
CH2=CH2 + 3O2 ⟶ 2CO2 + 2H2O
Реакция галогенирования этана и этилена:
CH3―CH3 + Br2 ⟶ CH3―CH2Br + HBr
CH2=CH2 + Br2 ⟶ CH2Br―CH2Br
Реакция дегидрирования этана:
CH3―CH3t, кат.⟶ CH2=CH2 + H2
Реакция гидратации этилена:
CH2=CH2 + H2O кат.⟶ CH3―CH2―OH
Реакция гидрогалогенирования этилена:
CH2=CH2 + HBr ⟶ CH3―CH2Br
При пропускании этилена через водный раствор перманганата калия происходит обесцвечивание этого раствора:
CH2=CH2 + [O] + H2O ⟶ HO―CH2―CH2―OH
Реакция полимеризации этилена:
nCH2=CH2 ⟶ (―CH2―CH2―)n
Задание 6
Рассчитайте массовые доли элементов в этене и бутене.
Mr(C2H4)=2•Ar(C)+2•Ar(H)=2•12+4•1=28
ωC2H4(C)=2•Ar(C)/Mr(C2H4)=2•12:28=0,857, или 85,7%
ωC2H4(H)=100%-ωC2H4(H)=100%-85,7%=14,3%
Mr(C4H8)=4•Ar(C)+8•Ar(H)=4•12+8•1=56
ωC4H8(C)=4•Ar(C)/Mr(C4H8)=4•12:56=0,857, или 85,7%
ωC4H8(H)=100%-ωC4H8(H)=100%-85,7%=14,3%
Не производя расчётов, укажите, чему равны массовые доли элементов в гексене C6H12. Массовые доли элементов в гексене C6H12 равны массовым долям элементов в этене и бутене, и составляют ωC6H12(C)=85,7% и ωC6H12(H)=14,3%
Поясните своё решение. Массовая доля углерода C6H12 (общая формула CnH2n) не зависит от количества его атомов, а только от значения их относительной атомной массы:
ωCnH2n(C)=n•Ar(C):Ar(CnH2n)=n⋅Ar(C):(n•Ar(C)+2n•Ar(H))=Ar(C):(Ar(C)+2•Ar(H))
Задание 7
Помимо полиэтилена, в качестве полимерного материала широко используют полипропилен. Из него изготавливают ковры, игрушки, химическую и бытовую посуду, канаты, изоляцию проводов, корпуса приборов. Напишите уравнение реакции получения полипропилена, укажите мономер, полимер и его элементарное звено.
| уравнение реакции получения полипропилена | Мономер | Полимер | Элементарное звено |
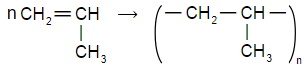 | 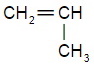 | 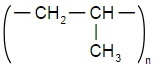 | 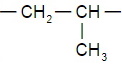 |
Рассчитайте объём этилена (н.у.), который потребуется для получения 115 л этилового спирта плотностью 0,8 г/мл.
Дано: V(C2H5OH)=115 л, ρ(C2H5OH)=0,8 г/мл=800 г/л
Найти: V(C2H4)-?
Решение
1. Рассчитываем массу этилового спирта.
m(C2H5OH)=ρ(C2H5OH)•V(C2H5OH)=800 г/л • 115 л=92000 г = 92 кг
2. Количество вещества этилового спирта рассчитываем по формуле: ʋ=m/M, где M ― молярная масса.
M(C2H5OH)=46 кг/кмоль
ʋ(C2H5OH)=m(C2H5OH)/M(C2H5OH)=92 кг : 46 кг/кмоль=2 кмоль
3. Составляем химическое уравнение: C2H4 + H2O ⟶ C2H5OH
По уравнению реакции ʋ(C2H4):ʋ(C2H5OH)=1:1, количества вещества одинаковые, поэтому:
ʋ(C2H4)=ʋ(C2H5OH)=2 кмоль
4. Рассчитываем объём этилена количеством вещества 2 кмоль по формуле: V=ʋ•Vm, где Vm― молярный объём.
V(C2H4)=ʋ(C2H4)•Vm=2 кмоль • 22,4 м3/кмоль=44,8 м3
Ответ: V(C2H4)=444,8 м3
Похожие новости
Комментарии
Часто задаваемые вопросы
Для чего создан сайт?
Чтобы помочь ученикам.
У вас нет ГДЗ для моего учебника (
Это не проблема. Напиши нам чего нет и мы добавим.
Как с вами связатся?
Через почту: admin@gdz.cool или обратную связь.
Вам можно предложить учебник для ГДЗ?
Да. Отправь учебник на электронную почту, чтобы мы его решили.
В каком классе вы учитесь?
Социальные сети