ГДЗ Химия 9 класc Габриелян О.С. , Остроумов И.Г., Сладков С.А., 2018, §30 АММИАК. СОЛИ АММОНИЯ
Красным цветом приводится решение, а фиолетовым ― объяснение. |
Упражнение 1 Составьте схему образования химической связи в молекуле аммиака.
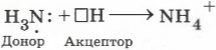
Упражнение 2 Охарактеризуйте физические и химические свойства аммиака. Свяжите их с областями применения этого соединения.
Физические свойства аммиака.
Аммиак ― бесцветный газ с резким характерным запахом, легче воздуха, хорошо растворяется в воде.
Водный раствор аммиака используется в медицине и в быту под названием аммиачная вода, а 10%-ный раствор аммиака в воде более известен под названием нашатырный спирт. Аммиак используется в качестве хладагента в промышленных холодильных установках, т.к. легко сжижается при повышении давления, а испарение сопровождается поглощением теплоты, в результате чего и происходит охлаждение.
Химические свойства аммиака.
1. Водный раствор аммиака изменяет окраску индикатора, т.к. гидрат аммиака – слабый электролит, он незначительно диссоциирует на катион аммония и гидроксид-анион:
NH3•H2O ⇄ NH4+ + OH-
2. Горит в избытке кислорода, при этом образуется азот и водяные пары:
4HN3 + 3O2 = 2N2 + 6H2O
3. Восстанавливает металлы с их оксидов:
2NH3 + 3CuO = N2 + 3Cu + 3H2O
Схема окислительно-восстановительной реакции.
N-3H3 + Cu+2O → N20 + Cu0 + H2O
2N-3 -6ē → N20 |6|6|1 ― процесс окисления
Cu+2 +2ē → 2Cu0 |2| |3 ― процесс восстановления
В приведённой реакции аммиак (за счёт атомов азота в степени окисления -3) — восстановитель.
4. Водный раствор аммиака реагирует с кислотами, образуя соли аммония:
NH3 + HCl = NH4Cl
2NH3 + H2SO4 = (NH4)2SO4
Аммиак ― исходное вещество для солей аммония, которые используют в качестве удобрений (фосфаты, хлорид, нитрат аммония), как компоненты взрывчатых веществ (нитрат аммония или аммиачная селитра), в пищевой промышленности (гидрокарбонат, карбонат, хлорид аммония), при выделке кож и (сульфат аммония).
Упражнение 3 Почему аммиак в окислительно-восстановительных реакциях проявляет свойства восстановителя? В аммиаке атом азота обладает минимальной степенью окисления (-3), поэтому он проявляет только восстановительные свойства.
Упражнение 4 В чём состоит донорно-акцепторный механизм образования ковалентной связи? Подтвердите свои рассуждения рассмотрением строения катиона аммония.
Донорно-акцепторный механизм образования ковалентной связи состоит в том, что связь формируется за счёт неподелённой пары электронов атома-донора и свободной орбитали атома-акцептора.
Например, образование катиона аммония происходит в результате возникновения ковалентной связи между атомом азота, имеющим свободную электронную пару (она называется неподелённой), и катионом водорода, который переходит к аммиаку от молекул кислоты. Первый атом называется донором, а второй ― акцептором.
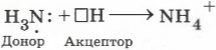
Какой ещё механизм образования ковалентной связи вам известен? Обменный механизм образования ковалентной связи. Например, образование молекулы хлороводорода.

Упражнение 5 Запишите сокращённое ионное уравнение качественной реакции на катион аммония.
NH4+ + OH- = NH3↑ + H2O
ПРИМЕНИТЕ СВОИ ЗНАНИЯ
Упражнение 1 Напишите уравнения реакций получения нитрида натрия и его взаимодействия с водой.
6Na + N2 = 2Na3N
Na3N + 3H2O = 3NaOH + NH3↑
Какая из этих реакций является окислительно-восстановительной?
Реакция получения нитрида натрия, т.к. в ходе химического превращения происходит изменение степени окисления атомов элементов натрия и азота:
6Na + N2 = 2Na3N
Схема окислительно-восстановительной реакции.
Na0 + N20 ⟶ Na3+1N-3
Восстановитель Na0 - 1ē ⟶ Na+1 |1|6|6 ― процесс окисления
Окислитель N20 + 6ē ⟶ 2N-3 |6| |1 ― процесс восстановления
Проводим вертикальную черту и пишем за ней число электронов, которые отдали и присоединили атомы натрия и азота. Находим наименьшее общее кратное для чисел 1 и 6 . Это число 6, которое записываем за второй вертикальной чертой посередине, и поделив его поочередно на 1 и 6, записываем результат за третьей чертой в строках, касающихся элементов натрия и азота. Множители 6 и 1 являются искомыми коэффициентами. Поскольку эти элементы изменили степень окисления полностью (в правой части схемы этот элемент ни в одном веществе не проявляет такую же степень окисления, как в исходном веществе) и разными являются индексы этих элементов в формуле исходного вещества и продукта реакции, поэтому ставим коэффициент 6 перед формулой натрия Na и коэффициент 1 (который обычно не пишем) перед формулой азота N2. Подбираем коэффициенты для остальных соединений.
Упражнение 2 С какими из перечисленных веществ реагирует аммиак: водород, азотная кислота, кислород, гидроксид натрия, вода, хлорид калия, оксид меди (II), железо, сульфат аммония? Запишите уравнения соответствующих реакций.
NH3 + HNO3 = NH4NO3
4NH3 + 3O2 = 2N2 + 6H2O
NH3 + H2O ⇄ NH4OH
2NH3 + 3CuO = N2 + 3Cu + 3H2O
Упражнение 3 В двух пробирках без подписи находятся растворы хлорида аммония и хлорида натрия. Какими способами можно распознать эти вещества? Распознать хлорид аммония можно с помощью щелочи NaOH. В пробирке с раствором хлорида аммония выделяющийся аммиак обнаруживают по запаху или посинению влажной красной лакмусовой бумаги. В пробирке с хлоридом натрия никаких изменений не наблюдаем.
Ответ подтвердите уравнениями соответствующих реакций.
NH4Cl + NaOH = NaCl + H2O + NH3↑
NH4+ + Cl- + Na+ + OH- = Na+ + Cl- + H2O + NH3↑
NH4+ + OH- = H2O + NH3↑
Упражнение 4 В 150 мл воды растворили 67,2 л аммиака (н.у.). Рассчитайте массовую долю аммиака в полученном растворе.
Дано: V(H2O)=150 мл, V(NH3)=67,2 л
Найти: ω(NH3)-?
Решение
1. Вычисляем количество вещества аммиака объёмом 67,2 л по формуле: ʋ=V:VM, где VM=22,4 л/моль при н.у.
ʋ(NH3)=V(NH3):VM=67,2 л : 22,4 л/моль=3 моль
2. Вычисляем массу аммиака в количестве вещества 3 моль по формуле: ʋ=m/M, где M=Mr г/моль.
M(NH3)=17 г/моль
m(NH3)=ʋ(NH3)•M(NH3)=3 моль • 17 г/моль=51 г
3. Рассчитываем массу воды:
m(H2O)=V(H2O)•ρ(H2O)=150 мл•1 г/мл=150 г. Поскольку ρ(Н2О)=1 г/мл, то для воды объём численно равен массе, поэтому данное действие не является обязательным.
4. Рассчитываем массу раствора:
m(раствора)=m(H2O)+m(NH3)=150 г + 51 г = 201 г
5. Вычисляем массовую долю аммиака в полученном растворе:
ω(NH3)=m(NH3):m(раствора)•100%=51 г : 201 г • 100%=25,4%
Ответ: 25,4%
ВЫРАЗИТЕ МНЕНИЕ
Упражнение 1 Постройте круговые диаграммы, отражающие массовые доли химических элементов в следующих солях: нитрат калия, нитрат аммония, нитрат кальция, сульфат аммония.
Mr(KNO3)=101, Mr(NH4NO3)=80, Mr(Ca(NO3)2)=164, Mr((NH4)2SO4)=132
ω1(N)=Ar(N):Mr(KNO3)=14:101=0,139, или 13,9%
ω2(N)=2•Ar(N):Mr(NH4NO3)=2•14:80=0,35, или 35%
ω3(N)=2•Ar(N):Mr(Ca(NO3)2)=2•14:164=0,171, или 17,1%
ω4(N)=2•Ar(N):Mr((NH4)2SO4)=2•14:132=0,212, или 21,2%
ω3(N)<ω1(N)<ω4(N)<ω2(N)
Какую из этих солей вы бы рекомендовали использовать в качестве азотного удобрения? Лучше всего использовать нитрат аммония, т.к. в нем наибольшее содержание азота (35%).
Похожие новости
Комментарии
Часто задаваемые вопросы
Для чего создан сайт?
Чтобы помочь ученикам.
У вас нет ГДЗ для моего учебника (
Это не проблема. Напиши нам чего нет и мы добавим.
Как с вами связатся?
Через почту: admin@gdz.cool или обратную связь.
Вам можно предложить учебник для ГДЗ?
Да. Отправь учебник на электронную почту, чтобы мы его решили.
В каком классе вы учитесь?
Социальные сети