ГДЗ Химия 9 класc Габриелян О.С. §5 Химические реакции. Скорость химической реакции
Красным цветом приводится решение, а фиолетовым ― объяснение. |
Что такое химическая реакция? В чём суть химических процессов? Химическая реакция ― это процессы, в результате которых разрушаются старые химические связи и возникают новые. Иными словами, из исходных веществ образуются новые вещества ― в этом суть химических процессов.
Упражнение 2 Дайте полную классификационную характеристику следующих химических процессов:
а) горению фосфора;
4P (т) + 5O2 (г) = 2P2O5(т) + Q
Реакция соединения, необратимая, экзотермическая, окислительно-восстановительная (взаимодействует простое вещество), гетерогенная, некаталитическая.
б) взаимодействию раствора серной кислоты с алюминием;
2Al (т) + 3H2SO4 (ж) = Al2(SO4)3 (ж) + 3H2 (г)↑
Реакция замещения, необратимая, экзотермическая, окислительно-восстановительная (взаимодействует простое вещество), гетерогенная, некаталитическая.
в) реакции нейтрализации;
NaOH (ж) + HCl (ж) = NaCl (ж) + H2O (ж)
Реакция обмена (ионного), необратимая, экзотермическая, гомогенная, некаталитическая.
г) образованию оксида азота (IV) из оксида азота (II) и кислорода.
2NO (г) + O2 (г) = 2NO2 (г)
Реакция соединения, необратимая, экзотермическая, окислительно-восстановительная (взаимодействует простое вещество), гомогенная, некаталитическая.
Упражнение 3
На основе личного опыта приведите примеры химических реакций, протекающих с различной скоростью.
Коррозия железа, окисление меди и серебра на воздухе, выцветание окрашенной ткани на солнце, брожение виноградного сока ― медленные химические реакции.
Горение спички или дров, гашение пищевой соды уксусом ― быстрые химические реакции.
Упражнение 4
Что такое скорость химической реакции? Скоростью химической реакции называют изменение концентрации прореагировавшего или образующегося вещества в единицу времени.
ʋ=Δc/Δt, или ʋ=(c1−c2)/(t2−t1)
От каких факторов она зависит? От природы, концентрации, площади соприкосновения реагирующих веществ (для твердых веществ), температуры, катализаторов.
Упражнение 5
Приведите примеры влияния различных факторов на биохимические и производственные химические процессы.
Природа реагирующих веществ используется в металлотермии — восстановления металлов из их оксидов с помощью активных металлов.
Увеличение концентрации газообразных реагирующих веществ азота и водорода путем увеличение давления смеси используют для ускорения синтеза аммиака.
Площадь соприкосновения веществ увеличивают измельчением серного колчедана при получении оксида серы (IV).
Температура используется для получения металла из руды в доменных печах или домнах.
Неорганические катализаторы используются для обезвреживания выхлопных газов автомобилей.
Катализаторы органической природы — ферменты — применяют в пищевой промышленности, медицине, кожевенной промышленности и других сферах деятельности.
Упражнение 6
На основе личного опыта приведите примеры влияния различных факторов на химические реакции, протекающие в повседневной жизни.
Температура. Для усиления процессов брожения, тесто ставят в теплое место, а для замедления порчи продуктов питания их хранят в холодильнике.
Концентрация реагирующих веществ. В вакуумной упаковке продукты питания не контактируют с кислородом воздуха, поэтому они дольше сохраняют свою свежесть.
Катализатор. Фермент каталаза, присутствующий в крови, выступает катализатором в использовании пероксида водорода для остановки кровотечений и для дезинфекции ран. Неорганические катализаторы используются для обезвреживания выхлопных газов автомобилей.
Упражнение 7
Почему продукты питания хранят в холодильнике? Во избежание быстрой порчи продуктов питания, т.к. понижение температуры замедляет скорость реакции гниения.
Упражнение 8
Химическую реакцию начали проводить при температуре 100°C, затем подняли до 150°C. Температурный коэффициент этой реакции равен 2. Во сколько раз возрастёт скорость химической реакции? В 32 раза.
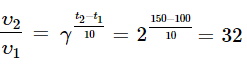
Похожие новости
Комментарии
Часто задаваемые вопросы
Для чего создан сайт?
Чтобы помочь ученикам.
У вас нет ГДЗ для моего учебника (
Это не проблема. Напиши нам чего нет и мы добавим.
Как с вами связатся?
Через почту: admin@gdz.cool или обратную связь.
Вам можно предложить учебник для ГДЗ?
Да. Отправь учебник на электронную почту, чтобы мы его решили.
В каком классе вы учитесь?
Социальные сети