ГДЗ Химия 10 класc Габриелян О.С. , Остроумов И.Г., Сладков С.А., 2019, §6 Алкины РЕШЕБНИК ОТВЕТЫ
Красным цветом приводится решение, а фиолетовым ― объяснение. |
Какие углеводороды называют алкинами? Алкинами называют углеводороды с общей формулой CnH2n-2, в молекулах которых содержится одна тройная углерод-углеродная связь С≡С.
Приведите названия, молекулярные и структурные формулы первых четырёх представителей гомологического ряда алкинов.
| Название | Молекулярная формула | Структурная формула |
| этин | C2H2 | HC≡CH
|
| пропин | C3H4 | HC≡C―CH3 |
| бутин-1 | C4H6 | HC≡C―CH2―CH3 |
| пентин-1 | C5H8 | H3C―C≡C―CH2―CH3 |
Задание 2
Сравните общие формулы диеновых и ацетиленовых углеводородов. Общие формулы CnH2n-2 одинаковые.
Можно ли однозначно сказать, к какому классу углеводородов принадлежит вещество с формулой C4H6? Нельзя, т.к. молекулярная формула не отражает пространственное строение молекулы. Например, формуле C4H6 могут соответствовать алкин и алкадиен.
Напишите структурные формулы одного алкадиена и одного алкина, имеющих такой состав, и назовите их.
| Структурная формула алкадиена C4H6: | Структурная формула алкина C4H6: |
| CH2=CH―CH=CH2 бутадиен-1,3 | H3C―C≡C―CH3 бутин-2 |
― углеродного скелета;
― положение связи (двойной или тройной);
― межклассовая изомерия; цис-транс-изомерия.
Задание 3
Назовите по международной номенклатуре следующие углеводороды:
а) 4-метилпентин-2 (опечатка в задании)
б) пентин-1
в) 3,3-диметилбутин-1
Задание 4
Напишите структурные формулы следующих алкинов:
а) бутин-1;
HC≡C―CH2―CH3
б) пентин-2;
CH3―C≡C―CH2―CH3
в) 4,4-диметилпентин-2;
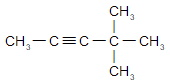
г) 2,2,5-триметилгексин-3.
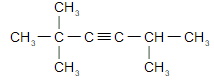
Завдання 5
Сравните химические свойства этилена и ацетилена. Какие общие черты и различия вы можете отметить? Ответ проиллюстрируйте уравнениями химических реакций.
Этилен и ацетилен сгорают в кислороде:
CH2=CH2 + 3O2 ⟶ 2CO2 + 2H2O
2HC≡CH + 5O2 ⟶ 4CO2 + 2H2O
В реакции гидратации этилена образуется спирт, а ацетилена – альдегид:
CH2=CH2 + H2O кат.⟶ CH3―CH2―OH
HC≡CH + H2O кат.⟶ CH3―CHO
Этилен и ацетилен вступают в реакцию гидрогалогенирования, при этом с ацетиленом она протекает в две стадии:
CH2=CH2 + HBr ⟶ CH3―CH2Br
HC≡CH + HBr ⟶ CH2=CHBr
CH2=CHBr + HBr ⟶ CH3―CHBr2
Этилен и ацетилен вступают в реакцию галогенирования, при этом с ацетиленом она протекает в две стадии:
CH2=CH2 + Br2 ⟶ CH2Br―CH2Br
HC≡CH + Br2 ⟶ CHBr=CHBr
CHBr=CHBr + Br2 ⟶ CHBr2―CHBr2
Этилен может вступать в реакцию полимеризации:
nCH2=CH2 ⟶ (―CH2―CH2―)n
Задание 6
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) CH4 ⟶ HC≡CH ⟶ CH3―CHO
2CH4 t⟶ HC≡CH + 3H2
HC≡CH + H2O кат.⟶ CH3‒CHO
б) CaC2 ⟶ HC≡CH ⟶ CHCl=CHCl ⟶ CHCl2―CHCl2
CaC2 + 2H2O ⟶ HC≡CH↑ + Ca(OH)2
HC≡CH + Cl2 ⟶ CHCl=CHCl
CHCl=CHCl + Cl2 ⟶ CHCl2―CHCl2
в) этан ⟶ этен ⟶ этин
CH3―CH3 t, кат.⟶ CH2=CH2 + H2
CH2=CH2 t, кат.⟶ HC≡CH + H2
Задание 7
На технический карбид кальция массой 40 г подействовали избытком воды. При этом образовалось 11,2 л газа (н.у.). Определите массовую долю примесей в карбиде кальция.
Дано: m(CaC2 c прим.)=40 г, V(C2H2)=11,2 л
Найти: ω(примеси)-?
Решение
1-й способ
1. Количество вещества этина рассчитываем по формуле: ʋ=V/Vm, где Vm― молярный объём.
ʋ(C2H2)=V(C2H2)/Vm=11,2 л : 22,4 л/моль=0,5 моль
2. Составляем химическое уравнение: CaC2 + 2H2O ⟶ C2H2↑ + Ca(OH)2
По уравнению реакции ʋ(CaC2):ʋ(C2H2)=1:1, количества вещества одинаковые, поэтому:
ʋ(CaC2)=ʋ(C2H2)=0,5 моль
3. Массу технического карбита кальция рассчитываем по формуле: m=ʋ•M, где M ― молярная масса.
M(CaC2)=64 г/моль
m(CaC2)=ʋ(CaC2)•M(CaC2)=0,5 моль • 64 г/моль=32 г
4. Рассчитываем массу примесей в техническом карбиде кальция.
m(примесей)=m(CaC2 c прим.)-m(CaC2)=40 г - 32 г=8 г
5. Рассчитываем массовую долю примесей в техническом карбиде кальция:
ω(примеси)=(m(примеси)/m(CaC2 c прим.))•100%=8 г : 40 г • 100%=20%
2-й способ
1. Составляем химическое уравнение:
х г 11,2 л
CaC2 + 2H2O ⟶ C2H2↑ + Ca(OH)2
64 г 22,4 л
Над формулами соединений CaC2 и C2H2 записываем неизвестную массу технического карбида кальция (х г) и приведенный в условии задачи объём этина (11,2 л), а под формулами соединений ― массу и объём количества вещества согласно коэффициентам в химическом уравнении. При н.у. 1 моль любого газа занимает объём 22,4 л.
M(CaC2)=64 г/моль, поэтому масса 1 моль=64 г
х=m(CaC2)=64 г • 11,2 л : 22,4 л=32 г
2. Рассчитываем массовую долю технического карбида кальция:
ω(CaC2)=(m(CaC2)/m(CaC2 c прим.))•100%=32 г : 40 г • 100%=80%
3. Рассчитываем массовую долю примесей в техническом карбиде кальция.
ω(примеси)=ω(CaC2 c прим.)-ω(CaC2)=100% - 80%=20%
Ответ: ω(примеси)=20%
Задание 8
Термохимическое уравнение реакции горения ацетилена имеет вид 2C2H2 + 5O2 ⟶ 4CO2 + 2H2O + 2600 кДж Рассчитайте количество теплоты, которое выделится при сгорании 44,8 л ацетилена (н.у.).
По термохимическому уравнению реакции с 44,8 л (2 моль) С2H2 выделяется 2600 кДж теплоты,
по условию задачи с 44,8 л С2H2 ― х кДж теплоты.
х = 22,4 л ● 2600 кДж : 22,4 л=2600 кДж
Ответ: 2600 кДж
Похожие новости
Комментарии
Часто задаваемые вопросы
Для чего создан сайт?
Чтобы помочь ученикам.
У вас нет ГДЗ для моего учебника (
Это не проблема. Напиши нам чего нет и мы добавим.
Как с вами связатся?
Через почту: admin@gdz.cool или обратную связь.
Вам можно предложить учебник для ГДЗ?
Да. Отправь учебник на электронную почту, чтобы мы его решили.
В каком классе вы учитесь?
Социальные сети