ГДЗ Химия 10 класc Габриелян О.С. , Остроумов И.Г., Сладков С.А., 2019, §5 Алкадиены. Каучуки РЕШЕБНИК ОТВЕТЫ
Красным цветом приводится решение, а фиолетовым ― объяснение. |
Какие углеводороды называют алкадиенами? Углеводороды, в молекулах которых содержатся две двойные углерод-углеродные связи и общая формула которых CnH2n-2, называют алкадиенами.
Напишите формулы одного гомолога и одного изомера пентадиена-1,3 с сопряжёнными двойными связями.
Гомолог пентадиена-1,3:
CH2=CH2―CH=CH―CH2―CH3 гексадиен-1,3
Изомер пентадиена-1,3:
CH3―CH=C=CH―CH3 пентадиен-2,3
Задание 2
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) CH3―CH3→ CH3―CH2Br → CH3―CH2―OH → CH2=CH―CH―CH2
CH3―CH3 + Br2 ⟶ CH3―CH2Br + HBr
CH3―CH2Br + NaOH ⟶ CH3―CH2―OH + NaBr
2CH3―CH2―OH t,Al₂O₃,ZnO⟶ H2C=CH―CH=CH2 + 2H2O + H2
б) CH3―CH(CH3)―CH2―CH3→ CH2=C(CH3)―CH=CH2→ изопреновый каучук
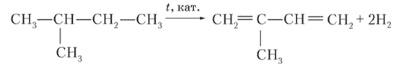 |
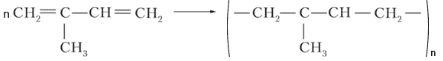 |
Сравните реакции присоединения алкенов и диеновых углеводородов. Ответ подтвердите уравнениями химических реакций на примере бутена-1 и бутадиена-1,3.
Реакции галогенирования.
Общее: образуются соответствующие галогеналканы.
Отличие: алкадиены реагируют с галогенами ступенчато, с промежуточным образованием галогеналкенов.
CH2=CH―CH2―CH3 + Br2 ⟶ CH2Br―CHBr―CH2―CH3
CH2=CH―CH=CH2 + Br2 ⟶ CH2Br―CH=CH―CH2Br
CH2Br―CH=CH―CH2Br + Br2 ⟶ CH2Br―CHBr―CHBr―CH2Br
Реакции гидрирования.
Общее: образуются соответствующие алканы.
Отличие: алкадиены реагируют с водородом ступенчато, с промежуточным образованием алкенов.
CH2=CH―CH2―CH3 + H2t, кат.⟶ CH3―CH2―CH2―CH3
CH2=CH―CH=CH2 + H2t, кат.⟶ CH3―CH=CH―CH3
CH3―CH=CH―CH3 + H2t, кат.⟶ CH3―CH2―CH2―CH3
Реакции гидрогалогенирования.
Общее: образуются соответствующие алканы, протекают согласно правилу Марковникова.
CH2=CH―CH2―CH3 + HBr ⟶ CH3―CHBr―CH2―CH3
CH2=CH―CH=CH2 + 2HBr ⟶ CH3―CHBr―CHBr―CH3
Задание 4
Как можно доказать непредельный характер 2-метилбутадиена-1,З? Качественная реакция на непредельные соединения, в частности на 2-метилбутадиен-1,З – обесцвечивание бромной воды:
Напишите уравнения реакций, подтверждающих ступенчатое протекание реакции.
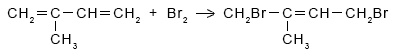 |
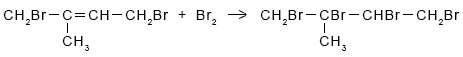 |
Найдите массу 2-метилбутадиена-1,З, который можно получить дегидрированием 72 кг 2-метилбутана, если выход продукта реакции составляет 80%.
Дано: m(C5H12)=72 кг, η(C5H8)=80%
Найти: mпракт.(C5H8)-?
Решение
1-й способ
1. Количество вещества 2-метилбутана рассчитываем по формуле: ʋ=m/M, где M ― молярная масса.
M(C5H12)=72 кг/кмоль
ʋ(C5H12)=m(C5H12)/M(C5H12)=72 кг : 72 кг/кмоль=1 кмоль
2. Составляем химическое уравнение: C5H12⟶ C5H8 + 2H2
По уравнению реакции ʋ(C5H12):ʋ(C5H8)=1:1, количества вещества одинаковые, поэтому:
ʋ(C5H8)=ʋ(C5H12)=1 кмоль
3. Вычисляем теоретическую массу 2-метилбутадиена-1,3 количеством вещества 1 кмоль по формуле: m=ʋ•M
M(C5H8)=68 кг/кмоль
mтеор.(C5H8)=ʋ(C5H8)•M(C5H8)=1 кмоль • 68 кг/кмоль=68 кг
4. Рассчитываем массу 2-метилбутадиена-1,3, полученную практически:
mпракт.(C5H8)=η(C5H8)•mтеор.(C5H8):100%=80% • 68 кг : 100%=54,4 кг
2-й способ
1. Составляем химическое уравнение:
72 кг х кг
C5H12⟶ C5H8 + 2H2
72 кг 68 кг
Над формулами соединений C5H12 и C5H8 записываем приведенную в условии задачи массу 2-метилбутана (72 кг) и неизвестную массу 2-метилбутадиена-1,3 (х кг), а под формулами соединений ― массы количества вещества согласно коэффициентам в химическом уравнении.
M(C5H12)=72 кг/кмоль, поэтому масса 1 кмоль=72 кг
M(C5H8)=68 кг/кмоль, поэтому масса 1 кмоль=68 кг
Теоретическую массу 2-метилбутадиена-1,3 рассчитываем с помощью пропорции:
72 кг / 72 кг = х кг / 68 кг, отсюда
х=mтеор.(C5H8)=72 кг • 68 кг : 72 кг=68 кг
2. Рассчитываем массу 2-метилбутадиена-1,3, полученную практически:
mпракт.(C5H8)=η(C5H8)•mтеор.(C5H8):100%=80% • 68 кг : 100%=54,4 кг
Ответ: mпракт.(C5H8)=54,4 кг
Задание 6
Англичанин Чарлз Макинтош предложил пропитывать плащевую ткань раствором натурального каучука, поэтому плащи, сшитые из такого материала, не промокали под сильным дождём; их назвали макинтошами. Однако они не были лишены недостатков, присущих натуральному каучуку: размягчались на солнце и становились хрупкими в мороз. В чём заключалось открытие американца Чарлза Гудьира, позволившее устранить эти недостатки плащевого материала? В 1839 году американский изобретатель Чарлз Гудьир открыл процесс вулканизации, который заключался в "сшивании" молекул каучука в единую пространственную трехмерную сетку с помощью серы, благодаря чему каучук становился сильнее и эластичнее, уменьшилась его растворимость.
Похожие новости
Комментарии
Часто задаваемые вопросы
Для чего создан сайт?
Чтобы помочь ученикам.
У вас нет ГДЗ для моего учебника (
Это не проблема. Напиши нам чего нет и мы добавим.
Как с вами связатся?
Через почту: admin@gdz.cool или обратную связь.
Вам можно предложить учебник для ГДЗ?
Да. Отправь учебник на электронную почту, чтобы мы его решили.
В каком классе вы учитесь?
Социальные сети