ГДЗ Химия 8 класc Габриелян О.С. , Остроумов И.Г., Сладков С.А., 2018, §27 РАСТВОРЫ. МАССОВАЯ ДОЛЯ РАСТВОРЁННОГО ВЕЩЕСТВА
Красным цветом даются ответы, а фиолетовым ― объяснения. |
Дайте определение растворов? Растворы — это гомогенные системы, состоящие из растворителя, растворённого вещества и продуктов их взаимодействия.
Что представляют собой гидраты? Нестойкие соединения переменного состава, которые образуются при химическом взаимодействии молекул воды с частицами растворённого вещества. Гидраты не имеют постоянного состава.
Задание 2
Как рассчитывается массовая доля растворённого вещества?
Массовой долей растворённого вещества в растворе называют отношение массы растворённого вещества к массе раствора:
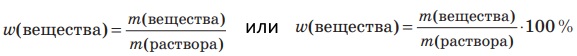
Задание 3
Найдите массовую долю хлорида натрия в растворе, полученном при растворении 15 г этой соли в 235 мл воды.
Дано: m(NaCl)=15 г, V(Н2О)=235 мл
Найти: ω(NaCl)-?
Решение
1 способ
1. Рассчитываем массу воды по формуле: m=ρ•V.
m(Н2О)=ρ(Н2О)•V(Н2О)=1 г/мл•235 мл=235 г. Для воды объём численно равен массе, поэтому данное действие не является обязательным.
2. Рассчитываем массу раствора:
m(р-ра)=m(Н2О)+m(NaCl)=235 г+15 г=250 г
3. Вычисляем массовую долю хлорида натрия в растворе:
ω(NaCl)=m(NaCl):m(р-ра)•100%=15 г : 250 г•100%=6%
2 способ
1. Рассчитываем массу воды по формуле: m=ρ•V.
m(Н2О)=ρ(Н2О)•V(Н2О)=1 г/мл•235 мл=235 г. Для воды объём численно равен массе, поэтому данное действие не является обязательным.
2.Рассчитываем массу раствора:
m(р-ра)=m(Н2О)+m(NaCl)=235 г+15 г=250 г
3.Для вычисления массы хлорида натрия составляем пропорцию и решаем её:
в 250 г раствора содержится 15 г NaCl, а
в 100 г раствора — х г NaCl
х=15 г • 100 г : 250 г=6 г, то есть ω(NaCl)=6%
Ответ: массовая доля натрий хлорида в полученном растворе составляет 6%.
Задание 4
В автомобильных аккумуляторах используют 36%-ный раствор серной кислоты. Рассчитайте массы кислоты и воды, необходимые для приготовления 2,5 кг аккумуляторного раствора.
Дано: ω(H2SO4)=36%, m(р-ра)=2,5 кг
Найти: m(H2SO4)-?, m(H2O)-?
Решение
1 способ
1. Вычисляем массу серной кислоты в растворе:
m(H2SO4)=m(р-ра)•ω(H2SO4):100%=2,5 кг •36%:100%=0,9 кг
2. Рассчитываем массу воды, необходимую для приготовления раствора серной кислоты:
m(Н2О)=m(р-ра)-m(H2SO4)=2,5 кг - 0,9 кг=1,6 кг
2 способ
1.Для вычисления массы серной кислоты, составляем пропорцию и решаем её:
в 100 г раствора содержится 36 г H2SO4, а
в 2500 г раствора — х г H2SO4
х=m(H2SO4)=36 г • 25000 г : 100 г=900 г=0,9 кг
2. Рассчитаем массу воды, необходимую для приготовления раствора серной кислоты:
m(Н2О)=m(р-ра)-m(H2SO4)=2,5 кг - 0,9 кг=1,6 кг
Ответ: необходимо взять 0,9 кг серной кислоты и 1,6 кг воды для приготовления 36%-ного раствора серной кислоты.
Задание 5
В косметике используют 15%-ный раствор глицерина (плотностью 1,26 г/см3). Рассчитайте массу глицерина, содержащегося в 250 мл раствора.
Дано: ω(глицерина)=15%, V(р-ра)=250 мл, ρ(р-ра)=1,26 г/см3, или 1,26 г/мл.
Найти: m(глицерина)-?
Решение
1 способ
1. Рассчитаем массу раствора по формуле: m=ρ•V.
m(р-ра)=ρ(р-ра)•V(р-ра)=1,26 г/мл •250 мл=315 г
2. Вычисляем массу растворённого глицерина в растворе:
m(глицерина)=ω(глицерина)•m(р-ра):100%=15%•315 г:100%=47,25 г
2 способ
1. Рассчитаем массу раствора по формуле: m=ρ•V.
m(р-ра)=ρ(р-ра)•V(р-ра)=1,26 г/мл •250 мл=315 г
2. Для вычисления массы растворённого глицерина в растворе, составляем пропорцию и решаем её:
в 100 г раствора содержится 15 г глицерина, а
в 315 г раствора — х г глицерина
х=315 г • 15 г : 100 г=47,25 г
Ответ: 47,25 г глицерина содержится в 15%-ном растворе глицерина.
Задание 6
Для засолки огурцов используют 5%-ный раствор поваренной соли (плотность 1,1 г/см3). Найдите массу и количество вещества соли, необходимые для приготовления 5 л такого раствора.
Дано: ω(NaCl)=5%, V(р-ра)=5 л=5000 мл, ρ(р-ра)=1,1 г/см3, или 1,1 г/мл.
Найти: m(NaCl)-?, n(NaCl)-?
Решение
1 способ
1. Рассчитываем массу раствора по формуле: m=ρ•V.
m(р-ра)=ρ(р-ра)•V(р-ра)=1,1 г/мл • 5000 мл=5500 г
2. Рассчитываем массу растворённой поваренной соли в растворе:
m(NaCl)=ω(NaCl)•m(р-ра):100%=5%•5500 г:100%=275 г
3. Количество вещества соли массой 275 г рассчитываем по формуле: n=m/M, где M―молярная масса.
Mr(NaCl)=Ar(Na)+Ar(Cl)=23+35,5=58,5, поэтому M(NaCl)=58,5 г/моль
n(NaCl)=m(NaCl)/M(NaCl)=275 г : 58,5 г/моль=4,7 моль
2 способ
1. Рассчитаем массу раствора по формуле: m=ρ•V.
m(р-ра)=ρ(р-ра)•V(р-ра)=1,1 г/мл • 5000 мл=5500 г
2. Для вычисления массы растворённой поваренной соли в растворе, составляем пропорцию и решаем её:
в 100 г раствора содержится 5 г NaCl, а
в 5500 г раствора — х г NaCl
х=m(NaCl)=5500 г • 5 г : 100 г=275 г
3. Mr(NaCl)=Ar(Na)+Ar(Cl)=23+35,5=58,5, поэтому M(NaCl)=58,5 г/моль, масса 1 моль=58,5 г
Для вычисления количества вещества поваренной соли, составляем пропорцию и решаем её:
в массе 58,5 г NaCl содержится 1 моль вещества, а
в массе 275 г NaCl — х моль вещества
х=n(NaCl)=275 г • 1 моль : 58,5 г=4,7 моль
Ответ: m(NaCl)=275 г, n(NaCl)= 4,7 моль
Задание 7
В химической лаборатории используют 35%-ный раствор пероксида водорода. Какую массу аптечного 3%-ного раствора можно приготовить из 1,5 кг раствора пероксида водорода, используемого в лаборатории?
Дано: ω(H2O2)=35%, m(р-ра)=1,5 кг, ωа(H2O2)=3%
Найти: mа(р-ра)-?
Решение
1 способ
1. Вычисляем массу растворённого пероксида водорода в 35%-ном растворе, используемого в химической лаборатории:
m(H2O2)=ω(H2O2)•m(р-ра):100%=35%•1,5 кг:100%=0,525 кг
2. Рассчитываем массу аптечного 3%-ного раствора:
mа(р-ра)=m(Н2О2):ωа(H2O2)•100%=0,525 кг : 3%•100%=17,5 кг
2 способ
1. Вычисляем массу растворённого пероксида водорода в 35%-ном растворе, используемого в химической лаборатории:
m(H2O2)=ω(H2O2)•m(р-ра):100%=35%•1,5 кг:100%=0,525 кг
2.
| H2O2 | 0,525 кг | 3% |
| H2O2 аптечный р-р | х м3 | 100% |
3 способ
1. Для вычисления массы растворённого пероксида водорода в 35%-ном растворе, используемого в химической лаборатории, составляем пропорцию и решаем её:
в 100 г раствора содержится 35 г H2O2, а
в 1500 г раствора — х г H2O2
х=m(H2O2)=1500 г • 35 г : 100 г=525 г
2.Для вычисления массы аптечного 3%-ного раствора составляем пропорцию и решаем её:
3 г H2O2 содержится 100 г аптечного раствора, а
в 525 г H2O2 — х г аптечного раствора
х=525 г • 100 г : 3 г=17500 г=17,5 кг
Ответ: можно приготовить 17,5 кг аптечного 3%-ного раствора пероксида водорода из 1,5 кг 35%-ного раствора, используемого в лаборатории.
Задание 8
Рассчитайте массовую долю аммиака в растворе, полученном растворением 6,72 л аммиака (н.у.) в 175 мл воды.
Дано: V(NH3)=6,72 л, V(H2O)=175 мл
Найти: ω(NH3)-?
Решение
1. Количество вещества аммиака в объёме 6,72 л рассчитываем по формуле: n=V/VM, где VM – молярный объём.
n(NH3)=V(NH3)/VM=6,72 л : 22,4 л/моль=0,3 моль
2. Массу амиака количеством вещества 0,3 моль рассчитываем по формуле: m=n•M, где M―молярная масса.
Mr(NH3)=Ar(N)+3•Ar(H)=14+3•1=17, M(NH3)=17 г/моль
m(NH3)=n(NH3)•M(NH3)=0,3 моль•17 г/моль=5,1 г
3. Рассчитываем массу воды по формуле: m=ρ•V.
M(Н2О)=ρ(Н2О)•V(Н2О)=1 г/мл•175 мл=175 г. Для воды объём численно равен массе, поэтому данное действие не является обязательным.
4. Рассчитаем массу раствора:
m(раствора)=m(Н2О)+m(NH3)=175 г + 5,1 г=180,1 г
5. Вычислим массовую долю аммиака в растворе:
ω(NH3)=(m(NH3)/m(раствора))•100%=(5,1 г : 180,1 г)•100%=2,83%
Ответ: ω(NH3)=2,83%
Задание 9
После упаривания 500 мл 10%-ного раствора карбоната натрия (плотностью 1,1 г/мл) его масса уменьшилась на 100 г. Какова массовая доля соли в полученном растворе?
Дано: ω(Na2CO3)=10%, m(р-ра)=500 мл, ρ(р-ра)=1,1 г/мл, m0(р-ра)=100 мл
Найти: mп(Na2CO3)-?
Решение
1 способ
1. Рассчитываем массу исходного раствора по формуле: m=ρ•V.
m(р-ра)=ρ(р-ра)•V(р-ра)=1,1 г/мл • 500 мл=550 г
2. Рассчитываем массу растворённого карбоната натрия в исходном растворе:
m(Na2CO3)=ω(Na2CO3)•m(р-ра):100%=10%•550 г:100%=55 г
3. Рассчитываем массу полученного раствора после упаривания:
mп(р-ра)=m(р-ра)-m0(р-ра)=550 г – 100 г=450 г
4. Вычисляем массовую долю карбоната натрия в полученном растворе:
ωп(Na2CO3)=(m(Na2CO3)/mп(р-ра))•100%=(55 г : 450 г)•100%=12,2%
2 способ
1. Рассчитываем массу исходного раствора по формуле: m=ρ•V.
m(р-ра)=ρ(р-ра)•V(р-ра)=1,1 г/мл • 500 мл=550 г
2. Для вычисления массы растворённого карбоната натрия в 10%-ном растворе, составляем пропорцию и решаем её:
в 100 г раствора содержится 10 г Na2CO3, а
в 550 г раствора — х г Na2CO3
х=m(Na2CO3)=550 г • 10 г : 100 г=55 г
3. Рассчитываем массу полученного раствора после упаривания:
mп(р-ра)=m(р-ра)-m0(р-ра)=550 г – 100 г=450 г
4. Для вычисления массы карбоната кальция в 100 г раствора, то есть его массовой доли в полученном растворе, составляем пропорцию и решаем её:
в 450 г раствора содержится 55 г Na2CO3, а
в 100 г раствора — х г Na2CO3
х=55 г • 100 г : 450 г=12,2 г, то есть ωп(Na2CO3)=12,2%
Ответ: массовая доля соли в полученном растворе составляет 12,2%.
Задание 10
При охлаждении 200 г 5%-ного раствора перманганата калия выпал осадок перманганата калия массой 4 г. Какова массовая доля соли в полученном растворе?
Дано: ω(KMnO4)=5%, m(р-ра)=200 г, m0(KMnO4)=4 г
Найти: ωп(KMnO4)-?
Решение
1. Вычисляем массу растворённого перманганата калия в исходном растворе:
m(KMnO4)=ω(KMnO4)•m(р-ра):100%=5%•200 г:100%=10 г
2. Рассчитываем массу растворённого перманганата калия в полученном растворе после охлаждения:
mп(KMnO4)=m(KMnO4)–m0(KMnO4)=10 г - 4 г=6 г
3. Рассчитаем массу полученного раствора после охлаждения:
mп(р-ра)=m(р-ра)-m0(KMnO4)=200 г – 4 г=196 г
4. Вычисляем массовую долю перманганата калия в полученном растворе:
ωп(KMnO4)=(mп(KMnO4)/mп(р-ра))•100%=(6 г : 196 г)•100%=3,1%
Ответ: массовая доля перманганата калия в полученном растворе составляет 3,1%.
Задание 11
Аргументируйте свою позицию на процесс растворения с точки зрения физической и химической теории растворов.
Растворения веществ — это физико-химический процесс, в котором присутствуют как физические, так и химические процессы.
С одной стороны, при растворении вещества происходит измельчение вещества в состояние молекул, ионов, а также диффузия частиц, образовавшихся между молекулами растворителя — это физические процессы.
С другой стороны, происходит взаимодействие растворителя с растворенным веществом, которое называется гидратацией или сольвацией, а продуктами являются гидраты (в случае растворителя воды) или сольваты (другие растворители) — это химические процессы, которые сопровождаются признаками реакции: тепловыми явлениями (например, при приготовлении растворов серной кислоты) или изменением окраски растворов (например, в случае сульфата меди) – все это свидетельствует о справедливости химической теории образования растворов.
Похожие новости
Комментарии
Часто задаваемые вопросы
Для чего создан сайт?
Чтобы помочь ученикам.
У вас нет ГДЗ для моего учебника (
Это не проблема. Напиши нам чего нет и мы добавим.
Как с вами связатся?
Через почту: admin@gdz.cool или обратную связь.
Вам можно предложить учебник для ГДЗ?
Да. Отправь учебник на электронную почту, чтобы мы его решили.
В каком классе вы учитесь?
Социальные сети