ГДЗ Химия 8 класc Габриелян О.С. , Остроумов И.Г., Сладков С.А., 2018, §23 ОКСИДЫ
Красным цветом даются ответы, а фиолетовым ― объяснения. |
Упражнение 1. Какие вещества называют оксидами?
Оксиды — это бинарные соединения, степень окисления кислорода в которых равна -2.
Из приведённого перечня формул веществ выпишите формулы оксидов металлов и оксидов неметаллов и дайте им названия: Na2O, H2S, K2SO4, PbO2, ZnO, LiOH, SO2, P2O5, O2, Cl2O7, OsCl3.
| Формулы и названия оксидов металлов | Формулы и названия оксидов неметаллов |
| Na2O ― оксид натрия ZnO ― оксид цинка PbO2― оксид свинца (IV) | SO2― оксид серы (IV) Р2O5― оксид фосфора (V) Cl2O7― оксид хлора (VII) |
а) SnO2; Оксид олова (IV)
Массовая доля элементов в оксиде олова (IV) SnO2:
Mr(SnO2)=Ar(Sn)+2•Ar(O)=119+2•16=151
ω(Sn)=(Ar(Sn)/Mr(SnO2))•100%=(119:151)•100%=78,8%
ω(O)=(2•Ar(O)/Mr(SnO2))•100%=(2•16:151)•100%=21,2%
Массовую долю кислорода можно найти еще и так:
ω(O)=100%-ω(Sn)=100%-78,8%=21,2%
б) Аl2O3; Оксид алюминия
Массовая доля элементов в оксиде алюминия Al2O3:
Mr(Al2O3)= 2•Ar(Al)+3•Ar(O)= 2•27+3•16=102
ω(Al)=(2•Ar(Al)/Mr(Al2O3))•100%=(2•27:102)•100%=52,9%
ω(O)=100%-ω(Al)=100%-52,94%=47,1%
в) СаО; Оксид кальция
Массовая доля элементов в оксиде кальция CaO:
Mr(CaO)=Ar(Ca)+Ar(O)=40+16=56
ω(Ca)=(Ar(Ca)/Mr(CaO))•100%=(40:56)•100%=71,4%
ω(O)=100%-ω(Ca)=100%-71,4%=28,6%
г) Р2O5. Оксид фосфора (V)
Массовая доля элементов в оксиде фосфора (V) P2O5:
Mr(P2O5)= 2•Ar(P)+5•Ar(O)= 2•31+5•16=142
ω(P)=(2•Ar(P)/Mr(P2O5))•100%=(2•31:142)•100%=43,7%
ω(O)=100%-ω(Al)=100%-43,7%=56,3%
ПРИМЕНИТЕ СВОИ ЗНАНИЯ
Упражнение 1. Сравните реакции обжига известняка и гашения извести. Реакция обжига известняка: CaCO3 = CaO + CO2↑ ― реакция разложения, эндотермическая.
Реакция гашения извести: CaO + H2O = Ca(OH)2― реакция соединения, экзотермическая.
Упражнение 2. Найдите объём углекислого газа (н.у.), который образуется при обжиге 150 кг известняка.
Дано: m(CaCO3)=150 кг
Найти : V(CO2)-?
Решение
I способ
1. Количество вещества заданной массы рассчитываем по формуле: ʋ=m/M, где M―молярная масса.
Mr(CaCO3)=Ar(Ca)+Ar(C)+3•Ar(O)=40+12+3•16=100, поэтому M(CaCO3)=100 кг/кмоль
ʋ(CaCO3)=m(CaCO3)/M(CaCO3)=150 кг : 100 кг/кмоль=1,5 кмоль
2. Составим химическое уравнение:
CaCO3 = CaO + CO2↑
По уравнению реакции количество вещества кальций карбоната (1 кмоль) и углекислого газа (1 кмоль) одинаковое, поэтому ʋ(СО2)=ʋ(CaCO3)=1,5 кмоль
3. Объём углекислого газа количеством вещества 1,5 кмоль вычисляем по формуле: V=ʋ•VM, где VM ― молярный объём.
V(СО2)=ʋ(СО2)•VM=1,5 кмоль • 22,4 м3/кмоль = 33,6 м3
II способ
1. Составим химическое уравнение:
150 кг х м3
CaCO3 = CaO + CO2↑
100 кг 22,4 м3
Над формулами соединений СаСO3 и СО2 записываем приведенную в условии задачи массу карбоната кальция (150 кг) и неизвестный объем углекислого газа (х м3), а под формулами соединений ― массу и объем соответствующего количества вещества согласно коэффициентам в химическом уравнении. При н.у. 1 кмоль любого газа занимает объем 22,4 м3.
Mr(CaCO3)=Ar(Ca)+Ar(C)+3•Ar(O)=40+12+3•16=100, поэтому M(CaCO3)=100 кг/кмоль, масса 1 кмоль = 100 кг
2. Объём водорода рассчитываем с помощью пропорции:
100 кг / 150 кг = 22,4 м3 / х м3, отсюда
х = 150 кг • 22,4 м3 : 100 кг
х=V(СО2)=33,6 м3
Ответ: V(СО2)=33,6 м3
Упражнение 3. Найдите объём углекислого газа (н.у.), который потребуется для взаимодействия с известковой водой, содержащей 2,5 моль гидроксида кальция.
Дано: ʋ(Ca(OH)2)=2,5 моль
Найти: V(CO2)-?
Решение
I способ
1. Составим химическое уравнение:
Ca(OH)2 + CO2 = CaCO3↓ + H2O
По уравнению реакции количество вещества гидроксида кальция (1 моль) и углекислого газа (1 моль) одинаковое, поэтому
ʋ(СO2)=ʋ(Ca(OH)2)=2,5 моль
2. Объём углекислого газа количеством вещества 2,5 моль вычисляем по формуле: V=ʋ•VM, где VM ― молярный объём.
V(СO2)=ʋ(СO2)•VM=2,5 моль • 22,4 л/моль=56 л
II способ
1. Составим химическое уравнение:
2,5 моль х л
Ca(OH)2 + CO2 = CaCO3↓ + H2O
1 моль 22,4 л
Над формулами соединений Ca(OH)2 и СO2 записываем приведенное в условии задачи количество вещества гидроксида кальция (2 моль) и неизвестный объем углекислого газа (х л), а под формулами соединений ― количество вещества и объем соответствующего количества вещества согласно коэффициентам в химическом уравнении.При н.у. 1 моль любого газа занимает объем 22,4 л.
2. Объём углекислого газа рассчитываем с помощью пропорции:
2,5 моль / 1 моль = х л / 22,4 л, отсюда
х = 22,4 л • 2,5 моль : 1 моль
х=V(СO2)=56 л
Ответ: 56 л
Упражнение 4. Оксид некоторого химического элемента имеет формулу Э2O3, массовая доля кислорода в нём составляет 63,2 %. Определите этот химический элемент.
Дано: формула оксида Э2O3, ω(O)=63,2%, или 0,632.
Найти: неизвестный элемент Э - ?
Решение
С формулы вычисления массовой доли элемента ω(O)=3•Ar(О)/Mr(Э2O3) найдём относительную молекулярную массу соединения Э2O3:
Mr(Э2O3)=3•Ar(О)/ω(O)=3•16:0,632=76
С формулы вычисления относительной молекулярной массы соединения Mr(Э2O3)=2•Ar(Э)+3•Ar(O) найдём относительную атомную массу неизвестного элемента:
Ar(Э)=(Mr(Э2O3)-3•Ar(O)):2=(76-3•16):2=14, следовательно, искомый элемент азот N.
Ответ: азот N
Упражнение 5. Даны формулы пяти оксидов: BeO, BaO, SrO, CaO, MgО. Не проводя вычислений, определите, молярная масса какого из оксидов наибольшая.
Молярная масса, выраженная в г/моль, численно равна относительной молекулярной массе вещества. Относительная молекулярная масса вещества равна сумме относительных атомных масс элементов с учетом их количества, входящих в состав молекулы или формульной единицы. Название и количество атомов второго элемента во всех формулах одинаковое, следовательно достаточно сравнить относительные атомные массы первых элементов всех формул.
Ar(Ве)=9, Ar(Ba)=137, Ar(S)=52, Ar(Ca)=40, Ar(Mg)=24
Ar(Ве)<Ar(Mg)<Ar(Ca)<Ar(S)<Ar(Ba)
Ответ: BaO
Упражнение 6. Какие типы химических связей и виды кристаллических решёток имеют оксиды, о которых рассказывается в параграфе?
Вещество, вода Н2О, образованное ковалентной полярной химической связью, имеет молекулярные кристаллические решётки.
Вещество, оксид углерода (IV), или углекислый газ СO2, образованное ковалентной полярной химической связью, имеет молекулярные кристаллические решётки.
Вещество, оксид кальция, или негашёная известь СаО, образованное ионной химической связью, имеет ионные кристаллические решётки.
Вещество, оксид кремния (IV), или кварц SiO2, образованное ковалентной полярной химической связью, имеет атомные кристаллические решётки.
Составьте схемы образования химических связей, соответствующих этим веществам.
| Формула вещества | Схема образования химических связей |
| Н2О | 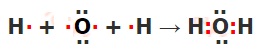 |
| СO2 |  |
| СаО | 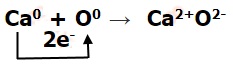 |
| SiO2 | 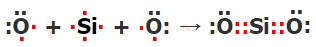 |
Похожие новости
Комментарии
Часто задаваемые вопросы
Для чего создан сайт?
Чтобы помочь ученикам.
У вас нет ГДЗ для моего учебника (
Это не проблема. Напиши нам чего нет и мы добавим.
Как с вами связатся?
Через почту: admin@gdz.cool или обратную связь.
Вам можно предложить учебник для ГДЗ?
Да. Отправь учебник на электронную почту, чтобы мы его решили.
В каком классе вы учитесь?
Социальные сети