ГДЗ Химия 11 класc Рудзитис Г.Е. Фельдман Ф.Г. §6 Валентность и валентные возможности атомов РЕШЕБНИК ОТВЕТЫ
Красным цветом приводится решение, а фиолетовым ― объяснение. |
Объясните сущность понятия "валентность" с точки зрения со временных представлений о строении атомов и образовании химической связи. Валентность химических элементов ― это число ковалентных связей, которыми данный атом соединён с другими атомами. Различают постоянную и переменную валентность. В большинстве случае валентность равна числу неспаренных электронов внешнго энергетического уровня атома элемента. Достаточно часто число неспаренных электронов увеличивается в процессе возбуждения атома, когда электрон с электронной пары на внешнем уровне переходит на свободную орбиталь, вследствие чего элементы могут иметь переменную валентность. Таким образом, валентность зависит от структуры внешнего электронного уровня элемента: наличия свободных орбиталей, спаренных и неспаренных электронов и общего количества внешних электронов.
Задание 2
Почему численное значение валентности не всегда совпадает с числом электронов на наружном энергетическом уровне? В некоторых случаях не все внешние электроны могут участвовать в образовании связей, а только неспаренные электроны, в виду отсутствия в электронной оболочке таких атомов свободных орбиталей и не возможности электронов распариваться. Это касается некоторых неметаллических элементов второго периода, а именно азота, кислорода и фтора, которые находятся в V, VI, VII группах соответственно и имеют высшую валентность III, II и I соответственно.
Задание 3
Почему максимальная валентность элементов 2-го периода не может быть больше четырёх? Максимальная валентность элемента равна числу неспаренных электронов. На втором энергетическом уровне имеются 4 орбитали (одна s-орбиталь и три p-орбитали), на каждой из них может находиться лишь по одному неспаренному электрону, поэтому максимальная валентность элементов 2-го периода не может быть больше четырёх.
Задание 4
Составьте электронные схемы, отражающие валентность азота в азотной кислоте и валентность углерода и кислорода в оксиде углерода (II).
Электронная схема, отражающая валентность азота в азотной кислоте:
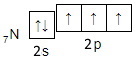
Электронная схема, отражающая валентность углерода в оксиде углерода (II):
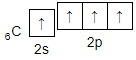
Электронная схема, отражающая валентность кислорода в оксиде углерода (II):
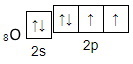
Задание 5
Почему по современным представлениям понятие "валентность" неприменимо к ионным соединениям? В ионных соединениях число связей между ионами зависит от строения кристаллической решетки, может быть различным и не связано с числом электронов на внешнем электронном уровне.
Задание 6
Какие закономерности наблюдают в изменении атомных радиусов в периодах слева направо и при переходе от одного периода к другому? В периодах атомные радиусы слева направо уменьшаются постепенно, а при переходе от одного периода к другому происходит резкое увеличение атомного радиуса.
Задание 7
На 18 г технического алюминия подействовали избытком раствора гидроксида натрия. При этом выделилось 21,4 л газа (н.у.). Определите процентное содержание примесей в техническом алюминии, если известно, что в нем не было других веществ, способных реагировать с гидроксидом натрия.
Дано: m(Al с прим.)=18 г, V(H2)=21,4 л
Найти: ω(прим.)-?
Решение
1 способ
1. Вычисляем количество вещества водорода объёмом 21,4 л по формуле: n=V/VM, где VM ― молярный объём.
n(H2)=V(Н2)/VM=21,4 л : 22,4 л/моль=0,955 моль
2. Составим химическое уравнение:
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2↑
По уравнению реакции n(Al)/2=n(H2)/3, поэтому:
n(Al)=2•n(Al):3=2•0,955 моль:3=0,64 моль
3. Вычисляем массу чистого алюминия количеством вещества 0,64 моль по формуле: m=n•M, где M ― молярная масса.
M(Al)=27 г/моль
m(Al)=n(Al)•M(Al)=0,64 моль • 27=17,2 г
4. Вычисляем массовую долю чистого алюминия:
ω(Al)=(m(Al)/m(Al с прим.))•100%=(17,2 г : 18 г )•100%=95,5%
5. Вычисляем массовую долю примесей в техническом алюминие:
ω(прим.)=ω(Al с прим.)-ω(Al)=100%-95,5%=4,5%
2 способ
1. Составим химическое уравнение:
х г 21,4 л
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2↑
54 г 67,2 л
Над формулами соединений Al и H2 записываем неизвестную массу алюминия (х г) и заданный в условии задачи объём водорода (21,4 л), а под формулами соединений ― массу и объём соответствующего количества вещества согласно коэффициентам в химическом уравнении. При н.у. 1 моль газа занимает объём 22,4 л, а 3 моль будут занимать в три раза больше объём, то есть 67,2 л.
M(Al)=27 г/моль, масса 1 моль=27 г, а масса 2 моль=54 г
х=m(Al)=21,4 л • 54 г : 67,2 л =17,2 г
2. Вычисляем массу примесей в техническом алюминие:
m(прим.)=m(Al с прим.)-m(Al)=18 г - 17,2 г=0,8 г
3. Вычисляем массовую долю примесей:
ω(прим.)=(m(прим.)/m(Al с прим.))•100%=(0,8 г : 18 г )•100%=4,5%
Ответ: ω(прим.)=4,5%
Похожие новости
Комментарии
Часто задаваемые вопросы
Для чего создан сайт?
Чтобы помочь ученикам.
У вас нет ГДЗ для моего учебника (
Это не проблема. Напиши нам чего нет и мы добавим.
Как с вами связатся?
Через почту: admin@gdz.cool или обратную связь.
Вам можно предложить учебник для ГДЗ?
Да. Отправь учебник на электронную почту, чтобы мы его решили.
В каком классе вы учитесь?
Социальные сети